ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 18
- Квантовые числа. Электронные спектроскопические формулы атомов.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: 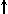 и
и 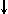 ..
..
- Основные положения теории электролитической диссоциации С.Аррениуса.
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия +11Na 1s22s22p63s1 при обычных условиях легко отдает наружный (3s1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия +11Na+ 1s22s22p6 не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
NaOH 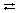 Na+ + OH–. Na+ + OH–.
| Гидpaтированныe анионы гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет. |
HCl 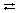 H+ + Cl–. H+ + Cl–.
| Катионы гидроксония H3O+, двигаясь к катоду, окрашивают лакмус в красный цвет. |
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
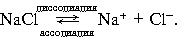
3. При 100 oC реакция заканчивается за 40 минут. Принимая температурный коэффициент реакции равным 3, определите время протекания этой же реакции при 200оС.
Дата добавления: 2015-01-21; просмотров: 1913;
