ЙОДИРОВАНИЕ
Наиболее широко применяемым методом йодирования белков является, вероятно, модифицированный метод, предложенный Greenwood, Hunter и Glover [27]. В нем используется окисляющий агент хлорамин Т, превращающий Na125I в свободный йод, который затем включается главным образом в остатки тирозина. При использовании этого метода могут йодироваться и остатки гистидина. Для сохранения максимальной иммунореактивности необходимо, чтобы на молекулу гормона приходился только один атом 131I или 125I, поскольку большая степень йодирования обычно снижает иммунологическую и биологическую активность гормона, изменяя его химические свойства [27].
В настоящее время применяют и другие способы йодирования. Второе по популярности место занимает, по-видимому, ферментативный метод с использованием лактопероксидазы [28, 29]. В присутствии перекиси водорода, добавляемой непосредственно в реакционную смесь, лактопероксидаза превращает Na125I в свободный йод, который избирательно включается в остатки тирозина. Поскольку перекись водорода является сильным окислителем, действие ее высоких концентраций на гормон может изменять его химические свойства; поэтому перекись водорода обычно добавляют двумя или тремя небольшими порциями, которые быстро используются в реакции. Другим, более новым, но менее распространенным методом йодирования, является метод, разработанный Bolton и Hunter [30]. В нем возможность вредных эффектов хлорамина Т, бисульфита натрия и перекиси водорода, применяемых в двух других методах йодирования, на гормон сводится к минимуму. С помощью хлорамина Т йодируют промежуточное соединение-сложный эфир, образованный N-оксисукцинимидом и 3-(р-оксифенил)-пропионовой кислотой, которое затем конденсируется с аминогруппами полипептидного гормона. Такой подход позволяет избежать воздействия на гормон сильных окислителей или восстановителей. Эта методика несколько громоздка и пока не получила широкого распространения.
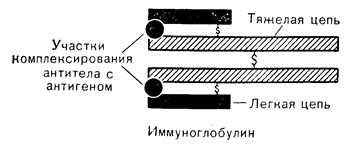
Рис. 5—2. Схематическое изображение молекулы g-глобулина или антитела. Участки, «узнающие» гормон, могут содержать разные аминокислотные области легких и тяжелых цепей иммуноглобулина. Легкие цепи ковалентно связаны с тяжелыми дисульфидными мостиками, обозначенными знаком S. Одна дисульфидная связь имеется и между двумя тяжелыми цепями. Недавно полученные данные указывают на Y-образную конфигурацию молекулы иммуноглобулина, в которой участки коплексирования с антигеном расположены в верхней части этой фигуры.
В настоящее время используют не Na131I, a Na125I, поскольку он обладает значительно большим периодом полураспада: 59 дней вместо 6. Однако при работе с 125I необходима особая тщательность, так как его удельная g-активность значительно ниже, чем у 131I. Стероидные гормоны и витамин D метят тритием, что позволяет получить более высокую удельную активность, чем с помощью метки 14C. Полипептиды, не имеющие в своем составе остатков тирозина или гистидина, можно модифицировать, вводя или присоединяя тирозин к их структуре без видимого изменения конформации нативного соединения. Выбирают такие замещения, которые с наименьшей вероятностью изменят конформацию молекулы.
Дата добавления: 2015-01-19; просмотров: 985;
