Влияние гормонрецепторных комплексов на хроматин
После этапа активации, обусловливаемого взаимодействием стероидных гормонов с их специфическими внутриклеточными рецепторными белками, гормонрецепторные комплексы приобретают способность быстро связываться с хроматином и влиять на транскрипцию специфических молекул мРНК. Отдельные белки, синтез которых, как было установлено, индуцируется действием стероидных гормонов на образование яРНК, перечислены в табл. 4—6.
По всей вероятности, будет показано, что многие другие белки, о которых известно, что на их содержание влияют стероидные гормоны, также регулируются через первичное действие гормонрецепторных комплексов на транскрипцию генов и скорость образования мРНК.
Таблица 4—6. Специфические белки, регулируемые стероидными гормонами через контроль синтеза мРНК
| Стероидные гормоны | Белок |
| Эстрогены | Овальбумип |
| Кональбумин | |
| Апо-ЛПОНП | |
| Вителлогепии | |
| Пролактин | |
| Прогестерон | Авидин |
| Утероглобин | |
| a2a-глобулин | |
| Альдолаза | |
| Глюкокортикоиды | Тирозинаминотрансфераза |
| Триптофаноксигеназа | |
| Глутаминсиитетаза | |
| Гормон роста | |
| Кортикотропин | |
| Вирус опухоли молочной железы |
Известны многие другие зависимые от стероидных гормонов белки (например, субстрат ренина, тироксинсвязывающий глобулин, кортикостероидсвязывающий глобулин), но уровень регуляции их продукции пока не установлен прямыми определениями образования мРНК при действии гормонов [1].
Точный механизм регуляции экспрессии специфических генов все еще изучается, но недавно были начаты исследования структуры и функции генов с целью определения главных стадий этого процесса. Большинство соответствующих сведений было получено при изучении влияния эстрогенов на синтез РНК и белка в двух тканях-мишенях: незрелой матке крыс [80] и яйцеводах цыплят [95]. При первичной стимуляции этих тканей эстрогенами в течение фазы клеточного роста и дифференцировки происходит синтез ДНК, всех видов РНК и многих белков [98]. В матке ранней реакцией на эстроген является синтез мРНК, кодирующей характерный «индуцированный белок» [99]. В яйцеводе цыпленка начальная реакция пролиферации клеток трубчатых желез сопровождается синтезом нескольких протеинов яичного белка, главным компонентом которых является овальбумин. После регресса первичной реакции на эстроген повторное воздействие эстрогеном или прогестероном вызывает в яйцеводе быстрое увеличение продукции мРНК, контролирующих синтез специфических «экспортируемых» белков, в том числе овальбумина и кональбумина. Скорость синтеза овальбуминовой мРНК, регистрируемая либо путем трансляции in vitro, либо с помощью гибридизации с комплементарной ДНК (кДНК), после введения эстрогена быстро увеличивается и тесно коррелирует со скоростью синтеза овальбумина. После отмены эстрогена число молекул овальбуминовой мРНК быстро уменьшается, что согласуется с представлением о необходимости присутствия эстрогенов для продолжения транскрипции мРНК на матрице овальбуминового гена [1, 95].
Эти, а также аналогичные данные об эффектах андрогенов и глюкокортикоидов in vivo и in vitro, подтверждают предположение о том, что стероидные гормоны действуют путем повышения синтеза специфических мРНК, исчезающих после удаления индуцирующего гормона. В некоторых случаях повышенный синтез мРНК снижается при добавлении второго гормона, ингибирующего действие первого, что наблюдается при добавлении антагонистов эстрогенов или андрогенов. Хотя эффекты стероидных гормонов заключаются обычно в увеличении скорости синтеза мРНК, но бывают случаи, когда гормональное воздействие приводит к «выключению» специфических мРНК, как это происходит, например, при ингибиторном действии глюкокортикоидов на синтез и секрецию АКТГ клетками передней доли гипофиза. Здесь уровень специфического 31 К-предшественника кортикотропина и b-липопротеина увеличивается после адреналэктомии и снижается при действии глюкокортикоидов, что свидетельствует о регуляции ими скорости образования молекул мРНК предшественника [100]. Аналогичный эффект глюкокортикоидов наблюдается в культуре клеток опухоли гипофиза, хотя острое подавление секреции АКТГ под действием глюкокортикоидов представляется слишком быстрым, чтобы быть обусловленным только снижением синтеза мРНК [101]. За исключением этой формы ингибиторного контроля, которая, вероятно, имеет общее значение для эффектов стероидных и тиреоидных гормонов по механизму обратной связи на секрецию соответствующих тропных гормонов, большинство воздействий стероидных гормонов на синтез белка первично реализуется, по-видимому, через дерепрессию специфических генов. Полный эффект гормон-рецепторных комплексов в ядрах клеток-мишеней включает, вероятно, несколько аспектов синтеза и процессинга РНК с главным влиянием на повышение синтеза РНК [81].
Гормонрецепторные комплексы оказывают прямое воздействие на активность РНК-полимеразы в изолированных ядрах, а также на матричную функцию хроматина клеток-мишеней. Эстрогены и андрогены стимулируют активность ядрышковой [I] и нуклеоплазменной [II] РНК-полимераз в соответствующих клетках-мишенях (матке и предстательной железе), а прогестеронрецепторные комплексы повышают матричную активность хроматина из яйцеводов цыплят, но не из тканей, не являющихся мишенями для прогестерона. Эти данные позволяют считать, что системы синтеза и процессинга РНК в гормонзависимых тканях и опухолях в отсутствие гормона ограничиваются или подавляются, отчасти за счет ограничения матричной функции хроматина, и что гормонрецепторные комплексы снимают это ингибирование. Поскольку пры стимуляции ткани, например эстрогенами, в клетках-мишенях синтезируется огромное количество белков, следует полагать, что в трофических эффектах гормонов должны принимать участие многие гормонрецепторные комплексы, даже если экспрессия генов главных секретируемых белков зависит от активации очень небольшого числа участков генома.
Накопление мРНК при действии стероидных гормонов могло бы определяться как прямыми быстрыми влияниями на транскрипцию" так и вторичными эффектами белков, образующихся вследствие начальной стимуляции синтеза мРНК. Так, влияние экдизона на хроматин слюнных желез насекомых заключается в индукции кратковременных вздутий (пуффов) на хромосомах, которые представляют собой активные гены, причем синтез белка необходим для образования поздних, но не ранних пуффов [102а]. Экдизон локализуется в специальных участках политопных хромосом, реагирующих образованием пуффов. Удаление стероида приводит к регрессии ранних, но не поздних пуффов. Это свидетельствует о том, что ранние эффекты стероида включают синтез белка,, индуцирующего поздние пуффы. Гормональные влияния на накопление мРНК могли бы опосредоваться и изменениями в скорости-их деградации, как это видно, например, по гораздо более длительному периоду полужизни овальбуминовой мРНК в яйцеводах получавших эстроген цыплят, чем у цыплят, лишенных эстрогенов. Таким образом, эффекты стероидрецепторных комплексов могли бы включать индукцию белка, увеличивающего стабильность мРНК, равно как и первичное действие, сводящееся к повышению синтеза мРНК. Быстрый прогресс представлений о структуре в организации гена обнаружил неожиданную сложность основных транскрипционных единиц в эукариотических клетках, а также процессинга мРНК, образующейся под влиянием стероидных гормонов и других регуляторов генов.
Структура гена и процессинг продуктов транскрипции (мРНК)
Известно, что между транскрипцией РНК на матрице ДНК и появлением транслируемой мРНК в цитоплазме существует несколько стадий. До недавнего времени полагали, что транскрипция приводит к образованию высокомолекулярной РНК, процессинг которой сводится к простому нарезанию специфических молекул мРНК, которые затем и проходят в цитоплазму, где транслируются с образованием соответствующих белков. Однако в настоящее время выяснилось, что стадии процессинга, участвующие в образовании мРНК, более сложны и включают такие модификации, как полиаденилирование 3 -конца и присоединение метилированного гуанозина и к 5 -концу молекулы мРНК. Последовательности-ДНК, определяющие первичную структуру мРНК, также оказались не смежными, как полагали раньше, а, как правило, разъединенными «вставками» (или интронами), которые отсутствуют в комплементарной структуре соответствующих мРНК. Таким образом, мРНК не прямо копируется с генной последовательности, а-транскрибируется вначале в виде гораздо более крупного продукта, из которого в ходе процессинга вырезаются промежуточные последовательности с образованием зрелой мРНК, непосредственно транслирующейся на рибосомном уровне [104].
Присутствие промежуточных последовательностей ДНК в эукариотических генах впервые было обнаружено в генах b-глобулина, легких цепей иммуноглобулинов и альбумина. Позднее такие вставки были найдены также в генах овальбумина, кональбумина и овомукоида, равно как и в других генах специфических белков [1, 104]. Современная точка зрения на организацию овальбуминового гена, отраженная на рис. 4—28, заключается в том, что структурный ген разъединяется по меньшей мере 7 промежуточными последовательностями. Стимуляция эстрогеном вызывает координированное повышение транскрипции структурных и промежуточных последовательностей овальбуминового гена с накоплением как высокомолекулярной РНК, содержащей ов альбуминовую последовательность, так и цитоплазматической овальбуминовой мРНК [105]. Молекулы крупного предшественника мРНК, содержащего промежуточные последовательности, подвергаются воздействию ферментов с вырезанием вставок и последующим сшиванием, что приводит к образованию зрелой мРНК (см. рис. 4—28). Функция промежуточных последовательностей (или интронов) в эукариотических структурных генах не выяснена. Одно из предположений заключается в том, что они ограничивают участки гена, кодирующие домены белка, ответственные за отдельные части его общей функции, и что структурные участки ДНК (или экзоны) сближались в процессе эволюции при участии интронов [106]. Применимы ли эти объяснения к овальбумину, не ясно, поскольку специфические функции этого белка яйцеводов не известны. Однако данные о том, что ген кональбумина (овотрансферрина) содержит 17 экзонов, позволяют проверить эту концепцию путем анализа функциональных доменов, принимающих участие в секреции (сигнальная последовательность) белка и связывании железа [107].
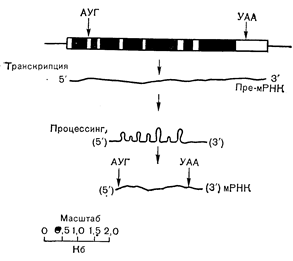
Рис. 4—28. Структурная организация и транскрипция гена овальбумина. Эстроген стимулирует экспрессию всего гена, а промежуточные последовательности затем вырезаются со сшиванием отрезков и образованием зрелой мРНК овальбумина цыплят (Chan и соавт. [1] в модификации). ов — овальбумин; светлый участок — структурный ген темный участок — вставочные последовательности ДНК: линия — боковые последовательности ДНК.
Анализ генома клеток яйцеводов вблизи овальбуминового гена позволил недавно обнаружить два соседних гена с последовательностями, гомологичными овальбуминовому гену [108]. Эти два дополнительных гена имели и интроны, сходные с таковыми в гене овальбумина, и экспрессировались при стимуляции эстрогенами, хотя и в меньшей степени, чем овальбуминовый ген. Такой кластер родственных генов мог бы возникнуть в процессе эволюции-путем параллельной сборки из смеси родственных и неродственных участков или путем удвоения исходного гена, в котором сочетание нитронов и экзонов было зафиксировано с самого начала [109]. Отражает ли разная экспрессия трех генов при действии эстрогенов различия в эффективности транскрипции или различия в последующем процессинге и стабилизации мРНК, пока не установлено. Организация овальбуминовой области генома аналогична таковой генов глобина, и кластеризация структурно и функционально близких генов может быть общей чертой генома эукариотических клеток [108].
Дата добавления: 2015-01-19; просмотров: 1205;
