Кинетика химических реакций металлургических процессов. Энергия активации.
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1 и делится на 693,53
Например для реакции
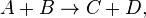 скорость можно выразить так:
скорость можно выразить так:
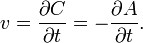
Закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Энергия активации— минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
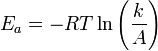 ,
,
где k — константа скорости реакции, 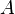 — фактор частоты для реакции,
— фактор частоты для реакции, 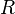 — универсальная газовая постоянная,
— универсальная газовая постоянная, 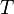 — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
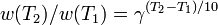
где 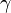 — температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур: от 10 до 400 ˚С, а также при энергии активации от 60 до 120 кДж/моль. Правило Вант-Гоффа не работает с крупными молекулами.
— температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур: от 10 до 400 ˚С, а также при энергии активации от 60 до 120 кДж/моль. Правило Вант-Гоффа не работает с крупными молекулами.
Дата добавления: 2015-03-19; просмотров: 1258;
