КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ. Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (V) измеряют по убыли количества субстрата или приросту продукта за единицу времени.
При ферментном катализе фермент (Е) обратимо соединяется с субстратом (S), образуя нестойкий фермент-субстратный комплекс (ES), который в конце реакции распадается с освобождением фермента (Е) и продуктов реакции (Р):
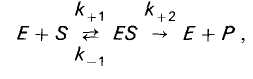
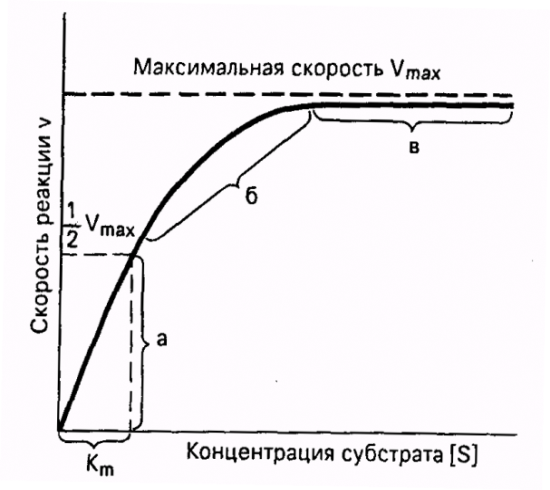
Важная особенность ферментативных реакций – насыщение фермента субстратом. При низкой концентрации субстрата скорость реакции прямо пропорциональна его концентрации. При высокой - скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [S] и целиком определяется концентрацией фермента (рис. 11).
|
| Рис. 11. Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента. |
KS – константа диссоциации фермент-субстратного комплексаES, обратна константе равновесия:
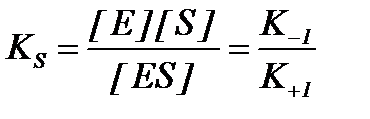
Чем меньше значение KS, тем выше сродство фермента к субстрату.
Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражает уравнение Михаэлиса-Ментен:
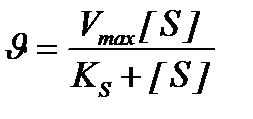 ,
,
u - скорость реакции, Vmax - максимальная скорость ферментативной реакции.
Бриггс и Холдейн усовершенствовали уравнение, введя в него константу Михаэлиса KM, определяемую экспериментально.
Уравнение Бриггса – Холдейна: 
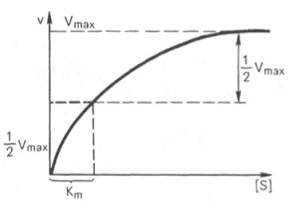
Константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость ферментативной реакции составляет половину от максимальной (рис. 12). Кm показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство.
Экспериментальные значения Кm для большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М. Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции.
|
| Рис. 12. Графическое определение константы Михаэлиса. |
Дата добавления: 2015-03-19; просмотров: 905;
