СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ
Первичная структура-последовательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Мономеры в молекулах нуклеиновых кислот соединены сложноэфирной связью, образованной фосфатным остатком одного мононуклеотида и 3’-гидроксильной группой пентозного остатка другого мононуклеотида (3’,5’-фосфодиэфирная связь).
Для изучения химического состава НК используют секвенирование – расщепление НК на фрагменты ферментами либо химическими реагентами и анализ продуктов при помощи электрофореза, хроматографии и др.
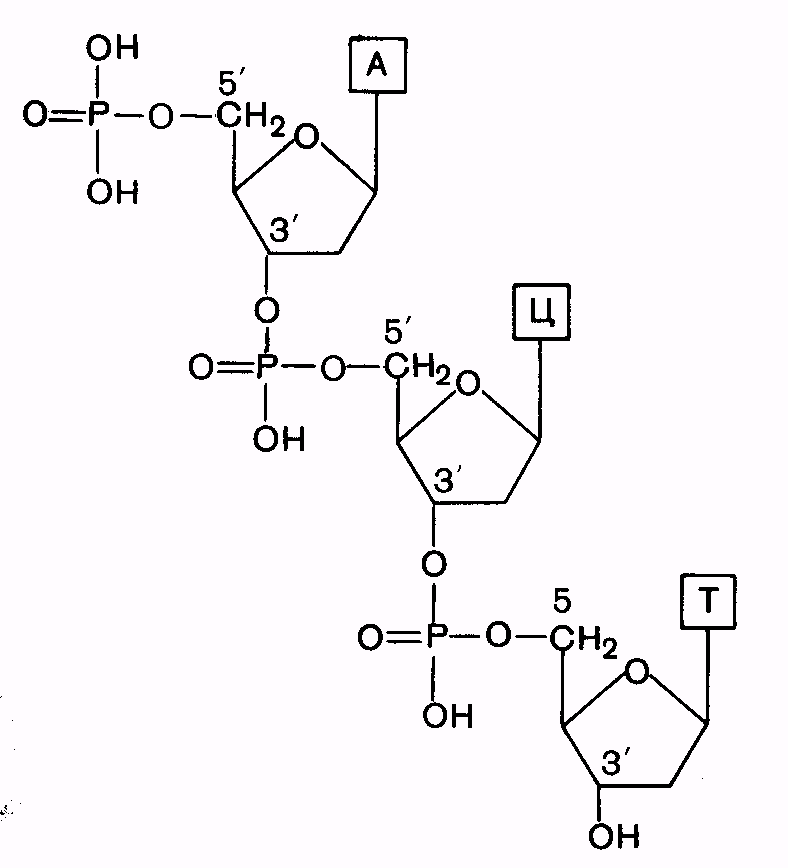
| Рис. 8. Схема первичной структуры ДНК. |
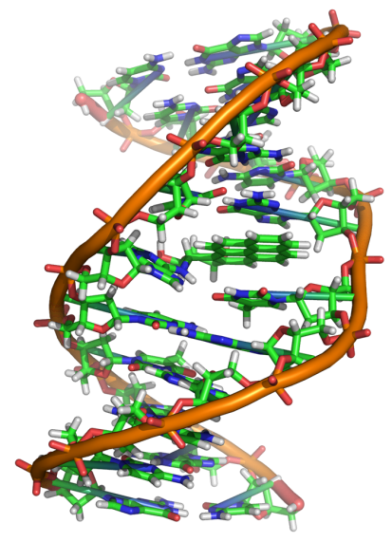
Вторичная структура.ДНК состоит из двух цепей, образующих правовращающую спираль, в которой обе полинуклеотидные цепи закручены вокруг одной и той же оси. Азотистые основания находятся внутри, а углеводные компоненты – снаружи (рис. 9).
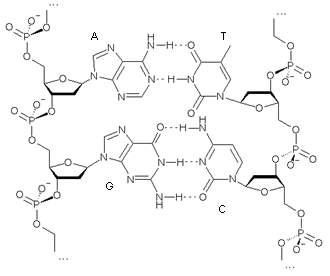
В молекуле ДНК основания уложены парами: пуриновые из одной цепи и пиримидиновые из другой. Взаимодействие пар А-Т и Г-Ц называют комплементарностью, а соответствующие азотистые основания – комплементарными (рис. 10). Цепи ДНК комплементарны друг другу. Стабильность А-Т пар обеспечивается двумя водородными связями, а пар Г-Ц-тремя.
Между азотистыми основаниями, собранными в стопку вдоль молекулы ДНК, возникают силы гидрофобных взаимодействий (стэкинг-взаимодействия) – вносят большой вклад в стабилизацию двойной спирали.
Обе цепи в молекуле ДНК имеют противоположную полярность: межнуклеотидная связь в одной цепи имеет направление 5’®3’, в другой – 3’®5’.
| |
| Рис. 9. Вторичная структура ДНК. | |
| |
| Рис. 10. Комплементарность цепей в ДНК. |
Конфигурация двойной спирали ДНК меняется от количественного содержания воды и ионной силы раствора. Существует более 10 форм ДНК.
Молекулы РНК построены из одной полинуклеотидной цепи. В этой цепи есть комплементарные участки, которые образуют двойные спирали. При этом соединяются водородными связями пары А-У и Г-Ц. Спирализованные участки РНК (шпильки) содержат 20-30 нуклеотидных пар и чередуются с неспирализованными участками.
Для тРНК Р. Холли предложил модель клеверного листа. Особенность такой структуры – спирализация полинуклеотидной цепи самой на себя в строго фиксированных зонах. Особенности структуры тРНК имеют прямое отношение к процессу трансляции, поэтому более подробно они рассмотрены в разделе биосинтеза белка.
Менее охарактеризована вторичная структура матричных и рибосомных РНК. Вторичная структура рРНК и мРНК характеризуется спирализацией самой на себя.
Во вторичной структуре ДНК и РНК есть нуклеотидные последовательности, называемые палиндромами (перевернутые повторы). Эти повторы служат основой для образования структуры шпилек или для формирования на отдельных участках тройных спиралей.
Третичная структура нуклеиновых кислот:двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы. Нативные молекулы тРНК имеют третичную структуру, которая отличается от «листа клевера» компактностью за счет складывания различных частей молекулы.
Нуклеиновые кислоты входят в состав нуклеопротеинов. Нуклеопротеины (НП) выполняют функции, связанные с хранением и реализацией генетической информации.
Существует 2 типа НП - дезоксирибонуклеопротеины (ДНП, содержат ДНК) и рибонуклеопротеины (РНП, содержат РНК). ДНП преимущественно находятся в ядре, а РНП - в цитоплазме. В состав НП входят гистоновые и негистоновые белки. Типичные представители НП - рибосомы(комплексы рибосомных РНК с белками), ДНП-хроматин (комплекс ДНК с гистонами и негистоновыми белками).
Гистоны - сильно щелочные белки с невысокой молекулярной массой. Содержат большое количество лизина и аргинина. 5 классов гистонов различаются по размерам, аминокислотному составу и величине заряда. Они принимают участие в структурной организации хроматина, нейтрализуя за счет положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК.
Природа негистоновых белков пока выяснена недостаточно.
Для многих белков хроматина характерны особенности структуры, обеспечивающие их связывание с ДНК: лейциновая застежка-«молния»; мотив α-спираль – поворот – α-спираль, «цинковый палец».
Контрольные вопросы
1. Дайте характеристику аминокислотам как структурным мономерам белков. В чем состоят особенности образования пептидной связи?
2. Дайте определение первичной структуры белка. В чем состоит определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы?
3. Какие связи стабилизируют вторичную структуру белка? Укажите виды вторичной структуры белка.
4. Что понимают под третичной структурой белка? Какие связи ее стабилизируют?
5. Охарактеризуйте четвертичную структуру белка. Что такое мономеры и олигомеры?
6. В чем состоит взаимосвязь структуры и функции белков?
7. Перечислите основные функции белков в организме.
8. Какие методы позволяют определить молекулярную массу белка?
9. Зависит ли растворимость белков от их аминокислотного состава?
10. Что понимают под денатурацией и ренатурацией белков? Какие агенты вызывают денатурацию?
11. Что такое изоэлектрическая точка белка?
12. Как используется процесс высаливания белков в медицине?
13. Перечислите функции альбуминов и глобулинов плазмы крови.
14. Приведите примеры фибриллярных белков.
15. Приведите классификацию сложных белков.
16. Рассмотрите структуру и функции гемоглобина А.
Дата добавления: 2015-03-19; просмотров: 1033;
