СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Доказано существование 4 уровней структурной организации белковой молекулы.
Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи. В белках отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии a-карбоксильных и a-аминогрупп аминокислот.
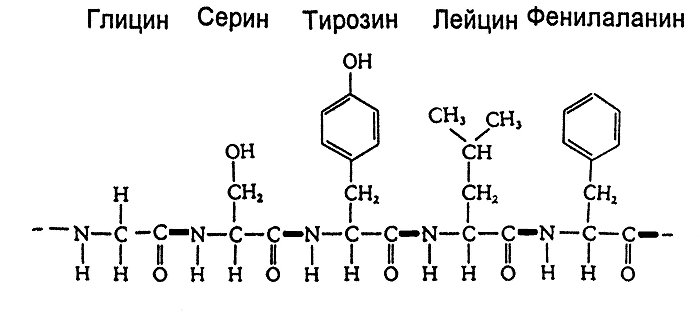
К настоящему времени расшифрована первичная структура десятков тысяч разных белков. Для определения первичной структуры белка методами гидролиза выясняют аминокислотный состав. Затем определяют химическую природу концевых аминокислот. Следующий этап - определение последовательности аминокислот в полипептидной цепи. Для этого используют избирательный частичный (химический и ферментативный) гидролиз. Возможно применение рентгеноструктурного анализа, а также данных о комплементарной нуклеотидной последовательности ДНК.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ упаковки полипептидной цепи в определенную конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре.
Стабильность вторичной структуры обеспечивается в основном водородными связями, однако определенный вклад вносят ковалентные связи – пептидные и дисульфидные.
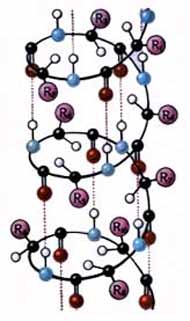
Наиболее вероятным типом строения глобулярных белков считают a-спираль. Закручивание полипептидной цепи происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Если цепи гемоглобина спирализованы на 75%, то пепсина-всего на 30%.
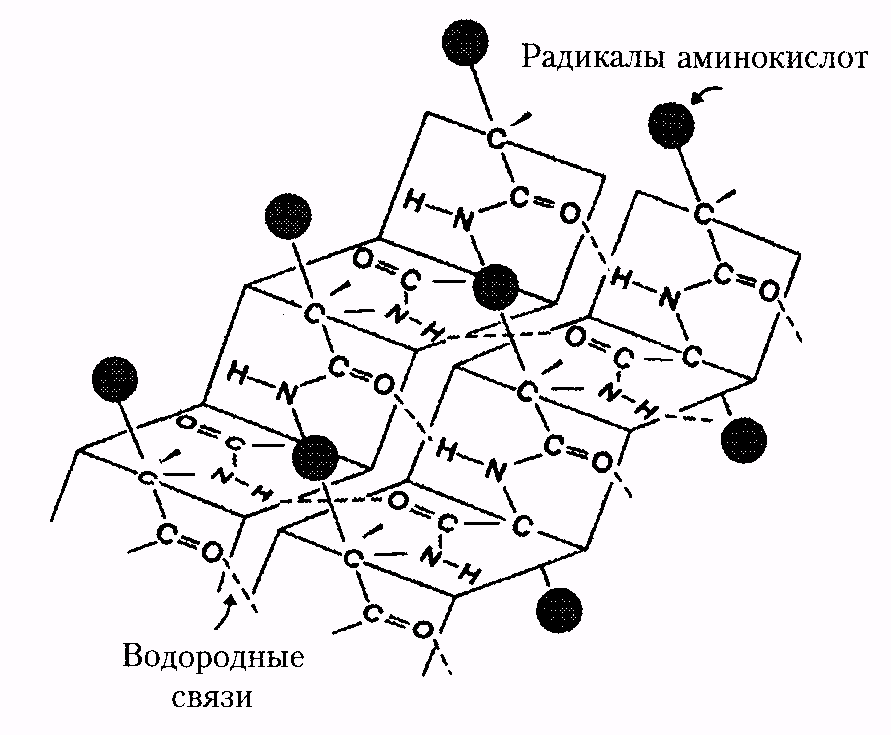
Тип конфигурации полипептидных цепей, обнаруженных в белках волос, шелка, мышц, получил название b-структуры. Сегменты пептидной цепи располагаются в один слой, образуя фигуру, подобную листу, сложенному в гармошку. Слой может быть образован двумя или большим количеством пептидных цепей.
 а
а
|  б
б
|
| Рис. 1. Вторичная структура белка: а - a-спираль, б - b-структура. |
В природе существуют белки, строение которых не соответствует ни β-, ни a-структуре, например, коллаген - фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
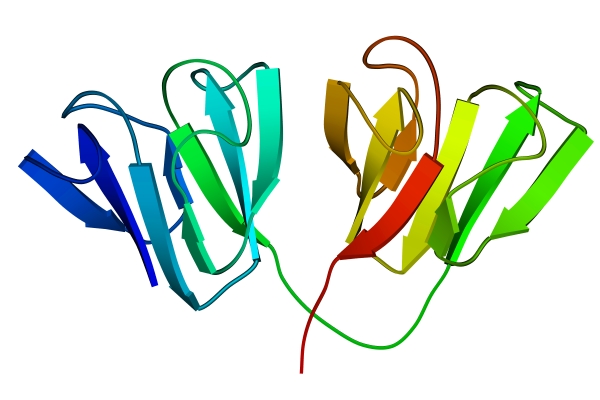
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, третичная структура которого была выяснена рентгеноструктурным анализом - миоглобин кашалота (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основную роль играют нековалентные связи (водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, гидрофобные взаимодействия и т.д.).
По современным представлениям, третичная структура белка после завершения его синтеза формируется самопроизвольно. Основной движущей силой является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот погружаются внутрь белковой молекулы, а полярные радикалы ориентируются в сторону воды. Процесс формирование нативной пространственной структуры полипептидной цепи называют фолдингом. Из клеток выделены белки, названные шаперонами. Они участвуют в фолдинге. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.).
Методами рентгеноструктурного анализа доказано существование уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.

| 
|
| Рис. 2. Третичная структура миоглобина | Рис. 3. Глобулярные домены в g-кристаллине (белке хрусталика глаза человека) |
Все биологические свойства белков связаны с сохранностью их третичной структуры, которую называют нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения частей пептидной цепи. Эти изменения не нарушают общей конформации молекулы. На конформацию молекулы белка оказывают влияние рН среды, ионная сила раствора, взаимодействие с другими веществами. Любые воздействия, приводящие к нарушению нативной конформации молекулы, сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка - способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой или разной первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Белковую молекулу, состоящую из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него цепь - протомером. Олигомерные белки чаще построены из четного числа протомеров, например, молекула гемоглобина состоит из двух a- и двух b-полипептидных цепей (рис. 4).
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулины. Субъединичное строение свойственно многим ферментам.
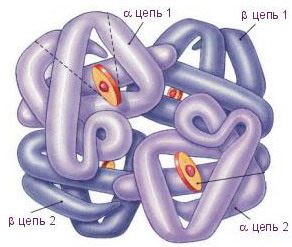
|
| Рис. 4. Молекула гемоглобина |
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. Биологическую активность белок приобретает только при объединении входящих в его состав протомеров. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Некоторые исследователи признают существование пятого уровня структурной организации белков. Это метаболоны -полифункциональные макромолекулярные комплексы разных ферментов, катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Дата добавления: 2015-03-19; просмотров: 1325;
