Теоретическое введение. Состояния вещества, которые могут существовать одновременно в равновесии друг с другом, называются различными фазами вещества
Состояния вещества, которые могут существовать одновременно в равновесии друг с другом, называются различными фазами вещества. В зависимости от агрегатного состояния различают газовую, жидкую и твердую фазы. Будем говорить далее о фазах чистого вещества. Переход из одной фазы в другую называют фазовым превращением или фазовым переходом. Характерная особенность фазовых превращений – скачкообразное изменение свойств вещества. Так, при нагревании льда его тепловое состояние меняется постепенно до тех пор, пока температура не становится равной 00С. Тогда лед начинает превращаться в жидкую воду, обладающую совершенно другими свойствами. После фазового перехода вещество состоит из тех же атомов, но обладает другими свойствами.
По классификации фазовых переходов, принадлежащей П. Эренфесту, в фазовых переходах I рода скачком изменяются такие термодинамические характеристики как плотность, объем, энтропия – первые производные от свободной энергии Гиббса. При этом выделяется или поглощается теплота. Примерами таких переходов являются процессы испарения и плавления вещества.
Фазовые переходы II рода осуществляются без выделения или поглощения теплоты, не меняются объем, энтропия. Однако скачком меняются производные от этих величин (вторые производные от свободной энергии Гиббса) – теплоемкость, коэффициент теплового расширения и т. д. Примерами таких переходов являются фазовые переходы типа "парамагнетик-ферромагнетик", переход в сверхпроводящее состояние, переход жидкого гелия в сверхтекучее состояние.
В данной работе необходимо измерить температуру фазового перехода – температуру плавления олова, что и позволит рассчитать изменение энтропии при этом фазовом превращении.
Фазовый переход I рода сопровождается выделением или поглощением некоторого количества тепла (так называемая скрытая теплота перехода). Согласно условиям равновесия такой переход происходит обратимо при постоянном давлении и постоянной температуре. Первое начало термодинамики вводит одну функцию состояния (величину, не зависящую от пути процесса) – внутреннюю энергию 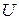 . Второе начало термодинамики вводит другую функцию состояния – энтропию
. Второе начало термодинамики вводит другую функцию состояния – энтропию 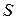 . Для обратимых процессов
. Для обратимых процессов
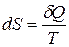 , (23.1)
, (23.1)
где 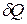 – бесконечно малое количество теплоты, сообщаемое системе при малом изменении ее состояния,
– бесконечно малое количество теплоты, сообщаемое системе при малом изменении ее состояния, 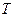 – ее температура. Символ
– ее температура. Символ 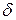 указывает на то, что изменение
указывает на то, что изменение 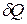 не является полным дифференциалом, в отличие от
не является полным дифференциалом, в отличие от 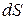 . То есть, количество теплоты
. То есть, количество теплоты 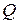 не является функцией состояния.
не является функцией состояния.
Можно воспользоваться вторым началом термодинамики и рассчитать изменение энтропии системы 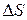 при переходе из состояния a в состояние b :
при переходе из состояния a в состояние b :
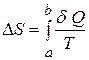 (23.2)
(23.2)
В нашем случае изменение энтропии при нагревании и плавлении олова 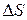 определяется как сумма изменения энтропии
определяется как сумма изменения энтропии 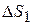 при нагревании олова до температуры плавления и изменения энтропии
при нагревании олова до температуры плавления и изменения энтропии 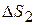 при плавлении олова.
при плавлении олова.
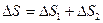 (23.3)
(23.3)
Выражение для 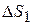 нетрудно получить, учитывая, что количество теплоты
нетрудно получить, учитывая, что количество теплоты 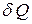 , получаемое веществом при изменении его температуры, равно
, получаемое веществом при изменении его температуры, равно 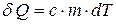 , где c – удельная теплоемкость,
, где c – удельная теплоемкость, 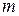 – масса вещества.
– масса вещества.
Тогда при нагревании от комнатной температуры 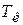 до температуры плавления олова
до температуры плавления олова 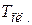 энтропия изменяется на
энтропия изменяется на
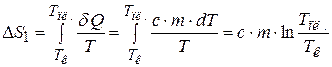 . (23.4)
. (23.4)
Так как плавление вещества происходит при постоянной температуре 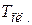 , то при расчете
, то при расчете 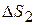 по формуле (23.1) величину
по формуле (23.1) величину 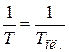 можно вынести из-под знака интеграла, а теплоту плавления
можно вынести из-под знака интеграла, а теплоту плавления 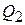 необходимо выразить через удельную теплоту плавления
необходимо выразить через удельную теплоту плавления 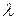 :
:
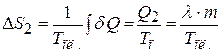 . (23.5)
. (23.5)
Окончательное выражение для изменения энтропии при нагревании и плавлении олова будет иметь вид:
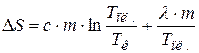 . (23.6)
. (23.6)
Дата добавления: 2015-03-19; просмотров: 572;
