Методы изучения свободных радикалов.
Радикалы обладают высокой реакционной способностью и изучать их обычными химическими методами невозможно; стандартные процедуры вроде хроматографии или центрифугирования совершенно бесполезны.
Биохимические анализы позволяют, правда, определять конечные продукты реакций, в которых предполагается участие радикалов, но всегда остаются вопросы: а действительно ли радикалы участвовали в процессе и какие именно? Важную роль при решении таких вопросов играет так называемый ингибиторный анализ. Классическим примером может служить применение фермента супероксиддисмутазы (СОД). Этот фермент катализирует реакцию взаимодействия (дисмутации) двух супероксидных радикалов с образованием перекиси водорода и молекулярного кислорода. Если добавление СОД тормозит изучаемый процесс, значит, для его протекания необходим супероксид-радикал и остается выяснить, в какой именно реакции этот радикал участвует (рис. 6).
Ингибиторный анализ используется и для изучения реакций с участием других радикалов. Так, для выяснения участия в каком-нибудь процессе реакций цепного окисления липидов (см. ниже) используют жирорастворимые «ловушки» липидных радикалов, которые «ведут» цепи окисления (рис. 7). К числу таких ловушек относятся токоферол (витамин Е) и некото-
| Karaлаза, пероксидазы |
| •о2 |
Супероксид-
дисмутаза

 ----------------- ►
----------------- ►
| "► Fes |


 -*- Fe2>
-*- Fe2>
 Ловушки НО' ------------------- > Ловушки НО' ------------------- >
|
| О2 |
 I
I
| ! |
Церулоплазмин
Карнозин
Цепные реакции Рис. 6. Водорастворимые антиоксиданты
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
рые синтетические соединения, например трет-бутилгидрокситолуол (ионол). Водорастворимые радикалы эффективно «перехватываются» аскорбиновой или мочевой кислотой. Для «улавливания» радикалов гидроксила (НО) используют маннитол или бензойную кислоту, а иногда -этанол. Однако далеко не всегда ловушки специфичны: многие из них реагируют не только с радикалами, но ис достаточно активными молекулами.
Прямым методом изучения свободных радикалов можно считать метод электронного парамагнитного резонанса (ЭПР), позволяющий обнаруживать молекулярные частицы и ионы металлов, обладающие неспаренным электроном. По амплитуде и форме сигналов (спектров) ЭПР можно определять концентрацию частиц с неспаренными электронами и судить об их строении.
К эффективным методам изучения реакций, идущих с участием радикалов, можно отнести метод хемилюминесценции (ХЛ). В основе его лежит то обстоятельство, что при взаимодействии радикалов друг с другом выделяется много энергии, которая может испускаться в виде фотонов (квантов света). Интенсивность такого свечения (ХЛ) пропорциональна скорости реакций, в которой участвуют радикалы, и, следовательно, показывает изменение их концентрации в ходе изучаемого процесса.
В биологических системах скорости образования радикалов кислорода или липидных радикалов в мембранах не так уж велики, зато очень велики скорости исчезновения этих радикалов, поэтому концентрация радикалов в каждый данный момент времени (так называемая стационарная концентрация) обычно очень мала. Выход из положения заключается в использовании так называемых спиновых ловушек в методе ЭПР и активаторов свечения. В первом случае к изучаемому образцу (например, к суспензии клеток, гомогенату ткани или раствору, где протекают реакции с участием свободных радикалов) добавляют особые вещества - спиновые ловушки. Например, в качестве ловушки для радикалов гидроксила (ОН) используют фенил-бутилнитрон (ФБН).
При взаимодействии ловушки с радикалом происходит присоединение радикала к ловушке с образованием нового, стабильного радикала, получившего название спинового аддукта (от английского слова add - добавлять, складывать). Сигналы ЭПР спиновых аддуктов разных радикалов слегка различаются по форме. Это позволяет идентифицировать радикалы, образующиеся в изучаемой системе. Для улавливания других радикалов (скажем, супероксида) используют другие ловушки.
3.1.7. Свободнорадикальное (перекисное) окисление липидов
Все радикалы, образующиеся в организме человека, можно разделить на природные и чужеродные. В свою очередь природные радикалы можно разделить на первичные, вторичные и третичные (рис. 8).
Первичные радикалы- те радикалы, образование которых осуществляется при участии определенных ферментных систем. Прежде всего к ним относятся радикалы (семихиноны), образующиеся в реакциях таких переносчиков электронов, как коэнзим Q (обозначим радикал как Q) и флавопротеины. Два других радикала - су-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
| Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ 6 Змсп № 532 |
пероксид ('00 ) и монооксид азота (N0) также выполняют полезные для организма функции.
Из первичного радикала - супероксида, а также в результате других реакций в организме образуются весьма активные молекулярные соединения: перекись водорода, гипохлорит и гидроперекиси липидов. Под действием ионов металлов переменной валентности, в первую очередь Ре21', из этих веществ образуются вторичные радикалы(радикал гидроксила и радикалы липидов), которые оказывают разрушительное действие на клеточные структуры.
Для защиты от повреждающего действия вторичных радикалов в организме используется большая группа веществ, называемых антиоксидантами, к числу которых принадлежат ловушки, или перехватчики свободных радикалов. Примером последних служат альфа-токоферол, тироксин, восстановленный убихинон (QH2) и женские стероидные гормоны. Реагируя с липидными радикалами, эти вещества сами превращаются в радикалы антиоксидантов, которые можно рассматривать как третичные радикалы.
Наряду с этими радикалами, постоянно образующимися в том или ином количестве в клетках и тканях организма человека, разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например светом лазера. Такие радикалы можно назвать чужеродными.К ним принадлежат также радикалы, образующиеся из по-
павших в организм посторонних соединении, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений.
Радикалы кислорода.Клетки-фагоциты (к которым относятся гранулоциты и моноциты крови и тканевые клетки - макрофаги), соприкасаясь с поверхностью клеток, бактерий, начинают энергично выделять супероксид: радикалы, образующиеся в результате переноса электрона от НАДФН-оксидазного ферментного комплекса, встроенного в мембрану клеток и внутриклеточных везикул-фагосом, на растворенный молекулярный кислород
НАДФН + 20=0 ->
-> НАДФ+ + 2( 00) + Н+ (супероксид анион-радикал)
При этом каждая молекула НАДФН, окисляясь, отдает два электрона в цепь переноса электронов, а каждый из этих электронов присоединяется к молекуле кислорода, в результате чего образуется супероксид анион-радикал (рис. 9).
Супероксидные радикалы, как мы увидим позже, могут нанести вред как самим фагоцитам, так и другим клеткам крови и, разумеется, микробам, вызвавшим активацию макрофага. Естественно, что все эти клетки стараются избавиться от супероксид-радикалов, для чего они вырабатывают ферменты, называемые суперок-сиддисмутазами. Различаясь по строению активного центра и структуре полипептидной цепи, все СОД катализируют одну иту же реакцию дисмутации супероксидного радикала:
род и перекись водорода. Судьба последней может быть разной (рис. 10).
В норме фагоциты используют перекись водорода для синтеза гипохлорита, выделяя специальный фермент - миелопероксидазу (МП). Миелопероксидаза катализирует реакцию миелопероксидаза
Н202 + С1->• Н20+ СЮ (гипохлорит)
Гипохлорит разрушает стенку бактериальной клетки и тем самым убивает бактерии. Перекись водорода диффундирует в клетки, но там разрушается в результате активности ферментов ка-талазы и глутатионпероксидазы (GSH-перокси-дазы), которые катализируют соответственно такие реакции:
каталаза
2НЮ2 -» 2Н20+ 02
| Н202+ 2GSH |
| GSSG+ 2H20 |
глутатионпероксидаза ->
В присутствии ионов двухвалентного железа перекись водорода разлагается с образованием гидроксильного радикала (НО):
Н202 + Fe2+ -» Fe3+ + НО+ НО
Эта реакция (известная как реакция Фентон) приводит к тяжелым последствиям для окружающих клеток. Радикал гидроксила чрезвычайно активен химически и разрушает почти любую встретившуюся ему молекулу. Действуя на SH-группы, гистидиновые и другие аминокислотные остатки белков, НО' вызывает денатурацию последних и инактивирует ферменты. В нуклеиновых кислотах НО' разрушает углеводные мостики между нуклеотидами и таким об-
разом разрывает цепи ДНК и РНК, в результате чего происходят мутации и гибель клеток. Внедряясь в липидный слой клеточных мембран, гидроксильный радикал запускает (инициирует) реакции цепного окисления липидов, что приводит к повреждению мембран, нарушению их функций и гибели клеток.
Гидроксильный радикал образуется не только в реакции Фентон, но и при взаимодействии ионов железа (Fe2+) с гипохлоритом (реакция Осипова):
СЮ + Fe2+ + Н+ -» Fe3+ + С1 + НО
Супероксидный радикал (00 )и продукты его метаболизма (Н202, НО', СЮ) называют активными формами кислорода.
Окись азота.К числу радикалов, синтезируемых клетками, относится монооксид азота 'NO, называемый также нитроксидом. Нитроксид образуется клетками стенок кровеносных сосудов (эндотелия); эта реакция катализируется гемсо-держащим ферментом N0 -синтазой. N0 играет ключевую роль в регуляции тонуса сосудов и кровяного давления: его недостаток приводит к гипертензии, избыток - к гипотензии. Нарушение метаболизма фактора расслабления вызывает заболевания, связанные с изменением кровяного давления.
' N0 выделяется также клетками-фагоцитами и вместе с супероксид-радикалами используется для борьбы с микробами (преимущественно грибковой природы). Полагают, что цитотоксическое действие N0 обусловлено его реакцией с супероксидом
N= О+ 00+ Н+~> ONOOH (пероксинит-рит)
Часть I. ОБЩАЯ НОЗОЛОГИЯ
|
| убихинона (QH , гидрохинон-форма): |
Пероксинитрит, образующийся в этой реакции, может разлагаться с образованием 'ОН:
О= N- О- ОН-> О= N- О+ ОН (радикал гидроксила)
Образование пероксинитрита и радикала гидроксила приводит к повреждению клеток. По-видимому, одна из функций супероксиддисму-тазы состоит в предотвращении образования пероксинитрита за счет удаления супероксида из зоны образования окиси азота.
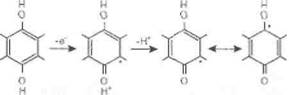
Радикал коэнзима Q.Биологическое окисление субстратов клеточного дыхания, таких как глюкоза, пировиноградная и янтарная кислоты и другие, осуществляется, как известно, в два этапа. На первом этапе в цикле трикарбоновых кислот происходит последовательный отрыв атомов водорода от субстрата и образование восстановленных форм пиридиннуклеотидов НАДН и НАДФН. На втором этапе электроны от НАДН и НАДФН переносятся по так называемой дыхательной цепи на кислород. В состав дыхательной цепи входят флавопротеиды, комплексы негемового железа, убихинон и гемопротеиды (цитохромы a, b и с ицитохромоксидаза). Схема дыхательной цепи дана на рис. 11.
| сн, |
 Важным звеном цепи переноса электронов служит убихинон (коэнзим Q) :
Важным звеном цепи переноса электронов служит убихинон (коэнзим Q) :
н,С-0
| СН,-СН=С=СН,)„Н |
Н,С-0
радикал которого (семихинон, QH на рис. 11) образуется либо при одноэлектронном окислении
гидрохинон катион-радикал нейтральный
гидрохинона радикал (семихинон)
либо при одноэлектронном восстановлении убихинона (Q на рис. 11):
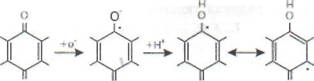
| о | О | О О |
| хинон | анион-радикал | нейтральный |
| хинона | радикал (семихинон) |
В норме этот радикал является рядовым участником процесса переноса электронов, но при нарушении работы дыхательной цепи он может стать источником других, менее безобидных радикалов, в первую очередь радикалов кислорода.
Основные стадии цепного окисления.Реакция цепного окисления липидов играет исключительную роль в клеточной патологии. Она протекает в несколько стадий, которые получили название инициирование, продолжение, разветвление и обрывцепи (см. схему 3).
Инициирование цепной реакции начинается с того, что в липидный слой мембран или липопротеинов внедряется свободный радикал.
митохондрий Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ 83
Чаще всего это радикал гидроксила. Будучи небольшой по размеру незаряженной частицей, он способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом образуются липидные радикалы:
НО + LH-> Н20 +L Липидный радикал (L) вступает в реакцию с растворенным в среде молекулярным кислородом, при этом образуется новый свободный радикал - радикал липоперекиси (LOO):
L + 02 -> LOO
Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L':
LOO-+ LH -> LOOH + L-
Чередование двух последних реакций как раз и представляет собой цепнуюреакцию перекисного окисления липидов (см. схему 3).
Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2i с гидроперекисями липидов:
Fe2+ + LOOH-> Fe3+ + НО + LOОбразующиеся радикалы LO' инициируют новые цепи окисления липидов (см. схему 3): LO + LH-> LOH +L ;L +02-> LOO-> и т.д.
В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2T) или друг с другом:
LOO + Fe2+ + Н+-> LOOH + Fe3+
LOO + InH -> In ■+ LOOH
LOO' + LOO'-> молекулярные продукты
Последняя реакция особенно интересна, поскольку она сопровождается свечением (хемилюминесценцией). Интенсивность этой хемилюминесценции очень мала, поэтому ее иногда называют «сверхслабым свечением». Интенсивность свечения пропорциональна квадрату концентрации свободных радикалов в мембранах, а
Схема 3 Цепная реакция перекисного окисления липидов
скорость перекисного окисления прямо пропорциональна концентрации тех же радикалов. Поэтому интенсивность «сверхслабого» свечения однозначно отражает скорость липидной пероксидации в изучаемом биологическом материале и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах.
|
| Рис. 12. Повреждающее действие перекисного окисления липидов на биологические мембраны |
Повреждающее действие пероксидации липидов. На рис.12 показаны основные мишени перекисного окисления липидов в мембранных структурах клеток. Повреждаются либо белковые структуры, либо липидный бислой в целом. В последнее время ученые уделяют все большее внимание взаимодействию мембран с нуклеиновыми кислотами в ядре и митохондриях. По-видимому, одним из результатов пероксидации
Часть I. ОБЩАЯ НОЗОЛОГИЯ
Наиболее известные антиоксиданты
Таблица 10
| Антиоксидант | Действие |
| Церулоплазмин (плазма крови) | Окисляет Fe2* до Fe3+ молекулярным кислородом |
| Апо-белок трансферрина (плазма крови) | Связывает Fe3* |
| Ферритин (цитоплазма) | Окисляет Fe2*n депонирует Fe3' |
| Карнозин | Связывает Fe2* |
| Супероксиддисмутазы (повсеместно) | Удаляют супероксид с образованием пероксида водорода |
| Каталаза (внутри клеток) | Разлагает пероксид водорода с выделением кислорода |
| Глутатионпероксидазы (в цитоплазме) | 1. Удаляют пероксид водорода за счет окисления глутатиона 2. Удаляют гидроперекиси липидов |
| Глутатионредуктаза | Восстанавливает окисленный глутатион |
| Токоферол, тироксин, стероиды | Перехватывают радикалы липидов |
| Аскорбиновая кислота | Регенерирует окисляющиеся токоферол и убихинон |
| Глутатион | Используется для восстановления пероксидов |
липидов может стать повреждение этих молекул со всеми вытекающими последствиями.
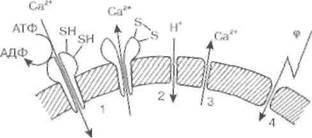
Наиболее чувствительны к переписному окислению липидов сульфгидрильные, или тиоловые, группы (- SH) мембранных белков: ферментов, ионных каналов и насосов. В ходе окисления тиоловых групп образуются радикалы (- S), которые затем либо взаимодействуют друг с другом с образованием дисульфидов (- SS-), либо связываются с кислородом с образованием сульфитов и сульфатов (- S03 и - S04). Большую роль в патологии клетки играет также повреждение ионтранспортирующих ферментов (например, Ca2t , М£2+-АТФазы), в активный центр которых входят тиоловые группы (рис. 12-1). Инактивация Са2+-АТФазы приводит к замедлению откачивания из клетки ионов кальция и ускорению их «протечки» в клетку(где их концентрация меньше). Это вызывает рост уровня ионов кальция в цитоплазме и повреждение клеточных структур.
Окисление тиоловых групп мембранных белков приводит к появлению дефектов в мембранах клеток и митохондрий. Под действием электрического поля через такие дефекты в клетки входят ионы натрия, а в митохондрии - ионы калия. В результате происходит увеличение осмотического давления внутри клеток и митохондрий и их набухание. Это приводит к еще большему повреждению мембранных структур.
Еще одним интересным примером может служить окисление белков и последующее образо-
вание белковых агрегатов в хрусталике глаза, вызванное пероксидацией липидов. Процесс приводит к помутнению хрусталика и может считаться одной из причин развития старческой и других видов катаракты у человека.
Наряду с белками и нуклеиновыми кислотами мишенью повреждающего действия перекисного окисления служит сам липидный бислой. Было показано, что продукты перекисного окисления липидов делают липидную фазу мембран проницаемой для ионов водорода и кальция (рис. 12-2; 12-3). Это приводит к тому, что в митохондриях окисление и фосфорилирование разобщаются и клетка оказывается в условиях энергетического голода. Одновременно из митохондрий в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры (см. выше).
Но, быть может, самый важный результат пероксидации - это уменьшение электрической стабильности липидного слоя,которое приводит к электрическому пробою мембраны собственным мембранным потенциалом (рис. 12-4). Электрический пробой вызывает полную потерю мембраной ее барьерных функций.
Клеточные системы защиты от повреждения свободными радикалами.Свободные радикалы преследовали живую материю с первых же моментов ее появления на Земле, и неудивительно, что в ходе эволюции клетки и организм в целом выработали нечто подобное глубокоэше-лонированной обороне, которая включает в себя ферменты и низкомолекулярные соединения, в
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
совокупности называемые антиоксидантами (табл. 10).
3.1.8. Стабильность липидного слоя мембран и явление электрического пробоя
Стабильность липидного слоя и электрический пробой мембраны.В отличие от белков и нуклеиновых кислот, которые в клетке собираются каждый по своему чертежу сложнейшими молекулярными роботами, липидный слой мембраны обладает способностью собираться сам по себе из молекул фосфолипидов и холестерина, если только они содержатся в водном растворе в достаточной концентрации. Это связано с особым свойством молекул липидов, входящих в состав мембран, которое принято называть ам-фифильностью,т. е. сродством одновременно к воде (гидрофильность) и к неводным средам, таким как растительное масло или жидкий парафин (гидрофобность). Молекула фосфолипида (основной липид клеточной и внутриклеточных мембран) имеет форму сплющенного цилиндра (рис. 13, А), один (меньший) конец которого хорошо растворяется в воде («полярная голова»), а другой - в воде не растворяется («жирный хвост») (рис. 13, Б). В водной среде такие молекулы самособираются в липидный бислой (рис. 13, В), который сам на себя замыкается, образуя везикулы - липосомы(рис. 13, Г).
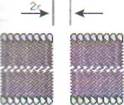
Под влиянием тепловых движений молекул в липидном слое могут образоваться дефекты, которые приводят к образованию заполненных водой трещин и щелей (назовем их «порами»). Через такие дефекты могут проходить водорастворимые молекулы иионы. Однако их появление крайне невыгодно с энергетической точки зрения, поскольку при этом граница раздела липид - вода сильно увеличивается, а это требует затраты работы на преодоление силы поверхностного натяжения. С ростом радиуса поры энергия системы растет пропорционально радиусу в соответствии с уравнением:
АЕ = nrlo,
где г - радиус поры; Z ■ толщина мембраны; а -энергия образования границы раздела площадью 1м2 (в системе СИ).
При наличии мембранного потенциала (т. е. разности потенциалов между водными фазами
по сторонам мембраны), который обозначается как фт, энергия образования поры снижается. Как показывает теория, в этом случае энергия системы изменяется с ростом поры по уравнению:
АЕ = nrlo ■ кг2 еоФ*т (s„ - ej/ 21,
где е0 - диэлектрическая постоянная, ец , ет - диэлектрическая проницаемость для воды и липидного слоя мембран соответственно; <р/( - мембранный потенциал.
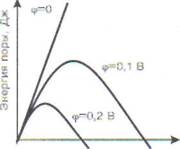
Изменение энергии поры с ростом ее радиуса при трех разных мембранных потенциалах показано на рис. 14, В. Видно, что с ростом радиуса энергия системы сначала растет, а затем начинает уменьшаться. Это означает, что после преодоления некоторого энергетического барьера рост поры будет происходить самопроизвольно, пока мембрана вообще не разрушится. Величина барьера снижается при увеличении мемб-

|
| «Полярная голова» |

|
| Липидный бислой |

|
«Жирный хвост»
г Липосома
Рис. 13. Самосборка фосфолипидов в бислой
Часть I. ОБЩАЯ НОЗОЛОГИЯ
ранногопотенциала. При небольших потенциалах, существующих в живой клетке (70 мВ на щдаоплазматической мембране и 175 мВ на внутренней мембране митохондрий), этого не происходит,потому что барьер достаточно высок.
С ростом потенциала может наступить момент, когда в мембране начнут формироваться и расти ■орыи она будет разрушена. Такое явление ноет название электрического пробоя мембраны.
|
О
| Образование водной поры |
Поверхность поры равна 2кН
|
| < с |
| о I- |
Радиус поры, мкм
0 40 80 120
_
Рис. 14. Электрический пробой мембран: А - появление в липидном бислое мембраны поры, заполненной водой; В - размер внутренней поверхности поры пропорционален ее радиусу; В - энергия мембраны с
порой в зависимости от ее радиуса. Величина потенциального барьера при росте поры уменьшается при увеличении потенциала на мембране; Г - возрастание тока в зависимости от потенциала пробоя
Величина потенциала, при котором начинается электрический пробой, называется потенциалом пробоя и обычно обозначается как U* или ф*. Величина потенциала пробоя, несколько различающаяся для мембран с разным составом белков и липидов, может служить количественной мерой электрической стабильности мембраны. Чем стабильнее мембрана, тем выше потенциал, который ее «пробивает» (т. е. ф*) .
Электрическая прочность различных мембранных структур. Явление электрического пробоя мембран изучалось многими авторами на искусственных мембранах и отдельных клетках. Мембраны обладают определенным сопротивлением R электрическому току I, которое при небольшой разности потенциалов ф между двумя сторонами мембраны является постоянной величиной. Иными словами, для мембраны соблюдается закон Ома:
I =Ф/Л.
Это означает, что зависимость между напряжением на мембране ф и током через мембрану I - линейная. Однако такая зависимость сохраняется при сравнительно небольших величинах ф: обычно не выше 200-300 мВ. При определенной разности потенциалов на мембране (потенциале пробоя ф*) происходит резкое возрастание тока (рис. 14, Г). При постоянном мембранном потенциале, если он превышает критическое значение, ток самопроизвольно нарастает во времени до полного разрушения мембраны.
На рис. 14 представлены результаты опыта на бислойных липидных мембранах. Аналогичные опыты были проведены на везикулярных мембранных структурах: фосфолипидных везикулах - липосомах, изолированных митохондриях и эритроцитах. В случае липосом и эритроцитов потенциал на мембране создавался за счет разности концентраций проникающих ионов по сторонам мембраны, в случае митохондрий - за счет энергии окисления субстратов. Измерение мембранного потенциала осуществлялось различными способами, например в случае митохондрий, - с помощью потенциалчувствительного флуоресцентного зонда. Явление пробоя мембран наблюдалось во всех случаях. В табл. 11 приведены величины потенциалов пробоя мембран всех этих объектов. Разумеется, потенциал пробоя во всех случаях выше потенциала, существующего на мембранах в живой клетке: иначе
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
Таблица 11 Электрические потенциалы (мВ) на мембранах клеток и потенциалы пробоя модельных и биологических мембран (A3. Путвинский, Т.В. Пучкова, ОМ. Париев, Ю.А. Владимиров)
| Объект | Разность потенциалов на мембране в клетках | Потенциал пробоя |
| Липидный бислой | - | 130-170 (БЛМ) |
| Клеточная мембрана | 70 (нервные и мышечные клетки) | 90-100 (эритроциты) |
| Внутренняя мембрана митохондрий | (митохондрии печени в присутствии субстратов и кислорода) |
все мембраны пробились бы своим собственным потенциалом и клетка не могла бы существовать. Однако запас электрической прочности невелик: всего 20-30 мВ. Это означает, что при снижении прочности мембраны может произойти ее «самопробой».
Электрический пробой как универсальный механизм нарушения барьерной функции мембран.Чрезвычайно важно, что электрическая прочность мембран, мерой которой служит потенциал пробоя, снижается под действием повреждающих факторов. Как уже говорилось, основными причинами нарушения барьерных свойств мембран при патологии являются: перекисное окисление липидов, действие мембранных фосфолипаз, механическое растяжение мембран или адсорбция на них некоторых белков.Изучение влияния этих действующих факторов на электрическую прочность мембран показало, что все они снижают потенциал пробоя мембран (рис. 15).
При повреждении мембранных структур происходит снижение потенциала пробоя <р* и может сложиться ситуация <р* < ф, когда мембрана будет «пробиваться» собственным мембранным потенциалом. К чему это приводит в условиях живой клетки? Предположим, клетку облучают
ультрафиолетовыми лучами, под влиянием которых в липидных мембранах активируется перекисное окисление. В неповрежденных митохондриях потенциал на мембране равен 175 мВ, а потенциал пробоя составляет около 200 мВ (см. табл. 11). В процессе активации перекисного окисления липидов потенциал пробоя начинает постепенно снижаться, и как только он достигает значения 175 мВ, мембрана митохондрий «пробивается» собственным мембранным потенциалом. То же происходит и при активации фосфолипаз: снижение потенциала пробоя до величины, равной существующему на мембране потенциалу, приводит к электрическому пробою мембраны и потере ею барьерных свойств. В условиях эксперимента на эритроцитах и митохондриях было показано, что осмотическое растяжение мембраны и добавление чужеродных белков, так же как и действие перекисного окисления и фосфолипазы, снижают потенциал пробоя мембран настолько, что они начинают «пробиваться» собственным мембранным потенциалом.
Естествен вопрос, почему такие, казалось бы, разные воздействия, как перекисное окисление липидов, ферментативный гидролиз фосфолипидных молекул, механическое растяжение мембраны или адсорбция полиэлектролитов, приво-
Рис. 15. Снижение электрической прочности БЛМ при действии ультрафиолетового излучения (УФ), фосфо-липазы А2, пептидов, при растяжении мембраны, вызванном разностью гидростатического давления (ДР)
Часть I. ОБЩАЯ НОЗОЛОГИЯ
дят к одному и тому же результату - снижению электрической прочности (т.е. уменьшению величины потенциала пробоя) мембраны? Теория электрического пробоя дает четкий ответ на этот вопрос. Самопроизвольному росту пор, случайно зародившихся в липидном бислое, препятствуют силы поверхностного натяжения на границе раздела фаз: липидный слой мембраны - окружающий водный раствор. Нужно приложить довольно большую разность потенциалов к мембране, чтобы преодолеть эти силы и вызвать рост поры. Все вещества, снижающие поверхностное натяжение (детергенты), облегчают самопроизвольный рост пор и снижают величину потенциала пробоя. И продукты перекисного окисления липидов, и продукты гидролиза фосфолипидов фосфолипазами (лизолецитины), и многие белки снижают поверхностное натяжение на границе раздела фаз и таким образом уменьшают электрическую прочность мембраны. Механическое растяжение мембраны действует сходно, так как противодействует силам поверхностного натяжения. Таким образом, электрический пробой мембран оказывается универсальным механизмом нарушения барьерной функции мембран при патологии.
Мембранные системы защиты от электрического пробоя.Известны два фактора, с помощью которых живые клетки повышают электрическую стабильность своих мембранных структур: асимметричный поверхностный потенциали холестерин.
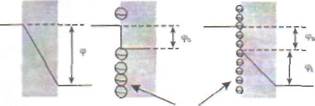
Поверхностный потенциал возникает на мембране в случае появления на поверхности липидного слоя заряженных химических группировок, например таких, как карбоксил или фосфат. Непосредственно на липидный бислой действует потенциал, равный разности величины мембранного потенциала (т.е. потенциала между водными средами, омывающими мембрану) и поверхностного потенциала (рис. 16). За счет неодинаковой плотности зарядов на поверхностях мембраны реальная разность потенциалов, приложенная к липидному бислою, может быть больше или меньше трансмембранной разности потенциалов. В большинстве биологических мембран заряды распределены между поверхностями таким образом, что разность потенциалов на липидном бислое меньше разности потенциалов между водными растворами, омывающими мем-
брану. Это снижает вероятность пробоя мембраны разностью потенциалов, которая существует между водными фазами по сторонам мембран в живых клетках.
Второй фактор, повышающий электрическую прочность мембран, - это холестерин. Было показано, что включение молекул холестерина в фосфолипидный бислой весьма заметно увеличивает электрическую прочность мембран, т. е. повышает потенциал пробоя (см. рис. 14, Г). Особенно заметно действие холестерина на поврежденные мембраны. Защитные свойства холестерина против электрического пробоя мембраны можно объяснить влиянием холестерина на вязкость липидного бислоя. Известно, что введение холестерина в фосфолипидный бислой может повысить вязкость последнего в 2-3 раза. Это приводит к замедлению образования и роста дефектов (пор) в липидном бислое мембран. Как уже говорилось, именно образование и увеличение дефектов в липидном бислое под действием приложенного электрического поля лежит в основе явления электрического пробоя.
Нарушение структурных (матричных) свойств липидного бислоя.Наиболее изучены три характеристики липидного слоя мембран, от которых зависят его свойства как жидкой фазы (матрицы), обеспечивающей функционирование мембранных белков и рецепторов: поверхностный заряд, вязкость и площадь липидного слоя.Все эти характеристики исследуются с помощью флуоресцентных и спиновых зондов.
|
| Группы,несущие заряд |
| Рис. 16. Влияние поверхностного потенциала (фд) на разность потенциалов на липидном слое мембран (ф,) при одном и том же мембранном потенциале (ф) |
Перекисное окисление липидов и действие мембранных фосфолипаз приводят к накоплению в липидной фазе мембран полиненасыщенных жирных кислот, которые придают мембране при нейтральных рН отрицательный заряд. Увели-
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
| чение отрицательных зарядов на поверхности мембраны облегчает связывание с мембраной ионов и белковых молекул, несущих положительные заряды, и, наоборот, уменьшает взаимодействие мембран с отрицательно заряженными молекулами или другими мембранами. Связывая больше ионов Са2*, мембраны с большим числом отрицательных зарядов на поверхности становятся более доступными для действия фосфолипаз, но зато хуже связывают ионы Fe2+, которые ускоряют пероксидацию липидов. С другой стороны, при перекисном окислении липидов происходит увеличение вязкости липидного слоя мембран. Значительное увеличение вязкости имеет место также при увеличении содержания в мембранах холестерина. Возрастание вязкости приводит к торможению работы мембранных рецепторов, а также встроенных в мембраны ферментов, таких как Na" -K+ -АТФаза и Са2* - Mg^-АТФаза. В свою очередь, это изменяет ионный баланс клетки и может привести к нарушениям метаболизма. С помощью флуоресцентных зондов было показано, что при перекисном окислении происходит уменьшение площади поверхности липидного слоя мембран, а также площади, занимаемой фосфолипидами на поверхности липопроте-инов плазмы крови. Это связано с окислением части жирно-кислотных цепей фосфолипидов и выходом их в водную фазу. Одним из результатов такого явления оказывается увеличение относительной концентрации холестерина в липид-ном монослое на поверхности липопротеинов, подвергнутых перекисному окислению. Липопротеины низкой плотности (ЛПНП) в результате этого переносят еще больше холестерина в клеточные мембраны сосудистой стенки, чем нео-кисленные ЛПНП, и их атерогенность возрастает. Липопротеины высокой плотности (ЛПВП), в норме акцептирующие холестерин с мембран клеток и обладающие антиатерогенным действием, в результате перекисного окисления полностью теряют способность акцептировать холестерин. Возрастание атерогенных (холестерин-донорных) свойств ЛПНП и утрата антиатерогенных (холестерин-акцепторных) свойств ЛПВП, несомненно, отно- |
сятся к числу причин того, почему перекисное окисление липидов в районе сосудистой стенки способствует развитию атеросклероза.
Дата добавления: 2015-03-19; просмотров: 1241;
