Повреждение рибосом и полисом
При токсических воздействиях на клетки происходит изменение конфигурации эндоплаз-матического ретикулума и связанных с ним рибосом. Например, при отравлении тринитротолуолом в клетках печени мембраны эндоплаз-матического ретикулума и расположенные на них рибосомы принимают форму различных завитков, не наблюдающихся в нормальных клетках. Синтез белков осуществляется на полисомах. Угнетение синтеза определенных белков, например синтеза гемоглобина при гипопласти-ческой анемии в клетках костного мозга, происходит на фоне уменьшения числа полисом и их распада на отдельные рибосомы.
3.1.3. Повреждение генетического аппарата клетки
Нуклеиновые кислоты весьма чувствительны к прямому действию повреждающих агентов, таких как облучение ионизирующей радиацией, ультрафиолетом, видимым светом в присутствии некоторых окрашенных соединений - фотосенсибилизаторов. В значительной мере по-
вреждения нуклеиновых кислот исправляются в результате репарации, которая осуществляется по целому ряду механизмов; в противном случае возникают нарушения в геноме (мутации) и работе системы биосинтеза белка. В последнее время многие необратимые изменения в клетках (например, при интоксикациях или входе процесса старения) связывают с повреждением генетического аппарата митохондрий.
3.1.4. Необратимое повреждение клеток при острой гипоксии
Среди многих причин, вызывающих повреждение клетки, наиболее частый случай в условиях организма человека - это недостаток кислорода (гипоксия) или же, напротив, избыточное образование радикалов кислорода - так называемый оксидативный стресс.
Недостаток кислорода приводит к снижению синтеза митохондриями аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной (АДФ) и ортофосфата. Недостаток АТФ делает невозможным функционирование многих систем клетки, для которых необходима затрата энергии в форме макроэргических связей АТФ. Именно энергетический голод, а не само по себе отсутствие кислорода приводит к нарушению функционирования клеток, а затем и к их повреждении!.
Но и наличие кислорода еще не означает полного благополучия. Дело не только втом, есть ли кислород в клетках, но еще и в том, на что он расходуется. Наряду с окислением субстратов тканевого дыхания, конечным этапом которого является перенос электронов на кислород в цепи переноса электронов в митохондриях, вклетках существуют и альтернативные пути восстановления кислорода, приводящие к появлению радикалов кислорода и липидов. Свободные радикалы- высокоактивные частицы, способные разрушать структуры клетки. Вызванные ими повреждения могут нанести клетке непоправимый вред.
Нормоксия и аноксия на уровне отдельной клетки. Вопытах с изолированными митохондриями показано, что скорость потребления кислорода этими частицами при наличии субстратов дыхания практически постоянна при всех концентрациях кислорода, вплоть до самых низких, соответствующих напряжению кислорода р02 = 1-2 мм рт. ст. Причина этого явления зак-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
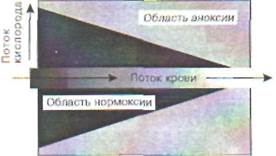
Рис. 2. Кислородный конус в участке ткани
лючается в высоком сродстве к кислороду конечного переносчика электронов по дыхательной щели - цитохромоксидазы. Поэтому отдельная клетка «выбирает» весь кислород из окружающей среды до конца, не испытывая кислородного голода, в весьма широком интервале р02 от 70 до 1-2 мм рт. ст. Это приводит к формированию так называемого «кислородного конуса» в тканях.
 Схематически кислородный конус представ-"гн на рис.2. Для простоты кровеносный сосуд изображен в виде трубки постоянного диаметра, а ткань - в виде однородной структуры, состоящей из одинаковых клеток, поглощающих кислород с постоянной скоростью. Кровь, протекающая по кровеносному сосуду, непрерывно отдает его окружающим тканям, в результате чего содержание кислорода снижается вдоль сосуда во ходу тока крови. С другой стороны, кислород, диффундирующий от сосуда в толщу тка-ив, поглощается клетками, так что его напряжение (р02) снижается по мере удаления от кровеносного сосуда. Там, где оно падает до 1-2 мм , рт. ст. (т. е. практически до нуля), клетки окалываются в состоянии как бы полной аноксии. Во всем слое ткани ближе этой границы они не ::г:ытывают кислородного дискомфорта, т. е. находятся в состоянии нормоксии. Очевидно, что чем ниже было исходное содержание кислорода в данном участке сосуда, тем тоньше слой ткани, полностью «выедающей» весь кислород. Иначе говоря, по ходу тока крови толщина слоя клеток в состоянии нормоксии сужается, образуя тем самым конус из нормально обеспеченных кислородом клеток. Протяженность конуса увеличивается с ускорением тока крови, а ширина его уменьшается с увеличением потребления кислорода клетками.
Схематически кислородный конус представ-"гн на рис.2. Для простоты кровеносный сосуд изображен в виде трубки постоянного диаметра, а ткань - в виде однородной структуры, состоящей из одинаковых клеток, поглощающих кислород с постоянной скоростью. Кровь, протекающая по кровеносному сосуду, непрерывно отдает его окружающим тканям, в результате чего содержание кислорода снижается вдоль сосуда во ходу тока крови. С другой стороны, кислород, диффундирующий от сосуда в толщу тка-ив, поглощается клетками, так что его напряжение (р02) снижается по мере удаления от кровеносного сосуда. Там, где оно падает до 1-2 мм , рт. ст. (т. е. практически до нуля), клетки окалываются в состоянии как бы полной аноксии. Во всем слое ткани ближе этой границы они не ::г:ытывают кислородного дискомфорта, т. е. находятся в состоянии нормоксии. Очевидно, что чем ниже было исходное содержание кислорода в данном участке сосуда, тем тоньше слой ткани, полностью «выедающей» весь кислород. Иначе говоря, по ходу тока крови толщина слоя клеток в состоянии нормоксии сужается, образуя тем самым конус из нормально обеспеченных кислородом клеток. Протяженность конуса увеличивается с ускорением тока крови, а ширина его уменьшается с увеличением потребления кислорода клетками.
Таким образом, подавляющее большинство
клеток в ткани может находиться в каждый данный момент времени лишь в одном из двух крайних состояний: нормоксии или аноксии. В ткани часть клеток находится в состоянии нормоксии, а часть - аноксии. Доля клеток, которые лишены кислорода, от общего числа клеток в ткани может служить количественной характеристикой степени гипоксии в ткани.
Как кровоток, так и потребление кислорода клетками могут изменяться во времени, так что одна и та же клетка может в одни моменты быть в состоянии аноксии, а в другие - нормоксии. Тогда можно говорить и о степени гипоксии для данной клетки, имея в виду ту часть времени, которую данная клетка провела в условиях отсутствия кислорода.
Митохондрии - главная мишень при гипок-сическом повреждении клеток. Пребывание клеток в состоянии аноксии в течение 30-90 мин (для разных тканей) приводит к их повреждению, т.е. необратимому нарушению функций. Ученых давно волновал вопрос, какие структуры клеток при этом повреждаются первыми, предопределяя последующую гибель всей клетки. Накопленный к настоящему времени экспериментальный материал позволяет утверждать, что такими структурами являются биоэнергетические станции клетки - митохондрии.

|
| 700 - |
| •ф |
| - о а. |
| 500 " |
При длительной гипоксии митохондрии в ткани повреждаются, о чем говорит снижение дыхательного контроля и кальцийаккумулиру-ющей способности (емкости) митохондрии (рис.3).
0 1
 Время аноксии,ч
Время аноксии,ч
Рис. 3. Повреждение митохондрий печени при аноксии
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
Ионы кальция и активация фосфолипазы при аноксии.В опытах с изолированными митохондриями было показано, что при инкубации этих органелл происходит их быстрое повреждение (за 15-20 мин при 37 °С), если вокружающей их среде нет кислорода и присутствуют ионы кальция в концентрациях (порядка 105 М), соизмеримых с концентрацией этих ионов в цитоплазме клеток в условии гипоксии. Повреждение вызвано активацией ионами кальция фермента фосфолипазы А2, расположенного на внутренней мембране митохондрий. Фосфолипаза А2 гидролизует сложноэфирные связи в молекуле фосфолипида, при этом образуются свободная жирная кислота (СЖК) и лизофосфолипид (ЛФ), например лизофосфатидилхолин при гидролизе фосфатидилхолина (лецитина):
снг-сн-снг сн2-сн-снг
I | | Фосфоли- | | |
О О О пазаАг О ОН О
I I I I I
-0-Р=0С=ОС=О+Н2О --------- ■--- ► ~0-Р=0 С=0
I t I I
О R| Rj R.-COO- ° R'
X X
Фосфатидилхолин СЖК Лизоформа
Здесь Rj, R2 - углеводородные цепи жирных кислот.
Как известно, фосфолипазы присутствуют в пищеварительном соке поджелудочной железы, а также практически во всех мембранных структурах клетки, включая митохондрии, лизосомы, плазматические мембраны. В мембранах фосфолипазы обычно находятся в малоактивном состоянии, так как фосфолипазы активируются ионами кальция и ингибируются ионами магния, а в цитоплазме как раз мало кальция (10 7 М и менее) и относительно много ионов Mg (около 103 М). Увеличение проницаемости плазматической мембраны при повреждении клетки или при открывании кальциевых каналов (т. е. возбуждении клетки), равно как ивыключение ионных насосов за счет недостатка энергии в клетке, приводит к увеличению концентрации кальция в цитоплазме. Некоторое повышение его концентрации (до 106 М) следует считать нормальным механизмом регуляции внутриклеточных процессов, так как кальций является вторичным посредником при действии многих гормонов, медиаторов и при генерации потенциалов действия в ряде клеток. Умеренная актива-
ция фосфолипазы А2 - также нормальное физиологическое явление, поскольку служит первым звеном в цепи образования физиологически активных производных арахидоновой кислоты.Чрезмерное увеличение концентрации ионов кальция в цитоплазме и активация фосфолипазы приводят к потере мембранами их барьерных свойств и нарушению функционирования клеточных органелл и клетки в целом.
В аэробных условиях ионов кальция вокруг митохондрий мало (10 7 - 10 6М) и фосфолипаза умеренно активна. В отсутствие кислорода исчезает электрический потенциал на мембране митохондрий, который удерживал ионы кальция в матриксе, икальций выходит в цитоплазму. Связываясь с активным центром фосфолипазы А2 (который как раз расположен с наружной стороны внутренней мембраны), ионы кальция активируют фермент. Гидролиз фосфолипидов приводит к потере мембраной ее барьерных свойств, и митохондрии теряют способность как к окислительному фосфорилированию, так и к закачиванию кальция в матрикс.
Последовательность нарушений в клетке при гипоксии.Последовательность изменений в клетке в результате прекращения доступа кислорода (аноксии)одинакова для самых различных тканей. Это показали опыты со срезами тканей, изолированными клетками и изолированными клеточными органеллами, в частности митохондриями. В клетках печени, находящихся в условиях аноксии при комнатной температуре, последовательность событий такова:
0-5 мин аноксии: снижение уровня АТФв клетке в 2-4 раза, несмотря на активацию гликолиза;
5-15 мин: повышение концентрации Са24 в цитоплазме клетки. Активация гидролитических ферментов, в том числе фосфолипазы А2 митохондрий. Содержание Са2+ в митохондриях повышается, так как они еще не повреждены;
15-30 мин: гидролиз митохондриальных фосфолипидов фосфолипазой А2 и нарушение барьерных свойств митохондриальной мембраны. Реоксигенация ткани на этой стадии приводит к активному набуханию митохондрий. Дыхательный контроль в митохондриях нарушен, окислительное фосфорилирование разобщено, способность митохондрий накапливать ионы кальция снижена;
30-60 мин: частичное восстановление функ-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
  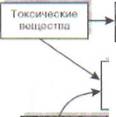
|
 
|
| Перекисное окисление | липидов |
| Повреждение мембранных структур клетки |
 zhh митохондрии, временное повышение дыхательного контроля, способности накапливать хжльций. Механизм компенсаторных процессов, врвводящих к временному улучшению функций житохондрий, неизвестен, но связан с функцией метки в целом, так как при анаэробной инкубации изолированных митохондрий это явление зе наблюдается;
zhh митохондрии, временное повышение дыхательного контроля, способности накапливать хжльций. Механизм компенсаторных процессов, врвводящих к временному улучшению функций житохондрий, неизвестен, но связан с функцией метки в целом, так как при анаэробной инкубации изолированных митохондрий это явление зе наблюдается;
60-90 мин: необратимое повреждение митохондрий и полная гибель клеток. При температуре тела человека все эти процессы протекают 1 два-три раза быстрее; кроме того, в разных тканях они протекают с разной скоростью: быс-■мк всего в мозге, медленнее - в печени, еще медленнее - в мышцах.
3.1.5. «Порочный круг» клеточной патологии
Увеличение внутриклеточного содержания ьция и нарушение биоэнергетических функ-митохондрий являются общими признака-■ для клеток, поврежденных в результате действия самых различных неблагоприятных факторов. Эти два события - не простое следствие «ругих изменений в поврежденных клетках: они ат в основе нарушения функций поврежден-клеток и могут рассматриваться как глав-ые звенья в цепи событий, приводящих к раз-вгтию неспецифической реакции клеток на по-■ивкдение. Взаимоотношения между первичным ■шреждением клеточных структур, процессами ««энергетики и содержанием кальция в цитоп-вае представлены в виде схемы на рис.4. Согласно этой схеме, первичными мишенями ргвствия повреждающих агентов служат мемб-ршиые структуры клетки, в которых могут подвязаться разрушению липидный бислой, рецеп-яры, белковые переносчики ионов и молекул, «иные каналы, а также встроенные в мембра-вн ферменты, включая ионные насосы. Увели-ввнс проницаемости мембран и подавление равен ионных насосов, непосредственно вызван-вые действием повреждающих факторов (токси-кжяе соединения, свободные радикалы и про-рвты липидной пероксидации, недостаток АТФ т.д.), приводят к увеличению концентрации гтрия и кальция в цитоплазме. Последнее со-квюждается дисбалансом внутриклеточных гнальных систем и активацией ряда фермен-:з. включая некоторые протеазы, эндонуклеа-
| Снижение уровня АТФ |
 Активация мембранных фосфолипаз
Активация мембранных фосфолипаз
 Увеличение
Увеличение
содержания Са8*
 в цитоплазме
в цитоплазме
Усиленная активация рецепторов
Рис. 4. «Порочный круг» клеточной патологии
зы и фосфолипазу А2. Гидролиз фосфолипидов мембран фосфолипазой приводит к дальнейшему нарушению барьерных свойств липидного бислоя, что вызывает еще больший рост уровня кальция в цитоплазме, набухание митохондрий и еще большее их повреждение. «Порочный круг» замыкается, и клетка может погибнуть.
3.1.6. Основные механизмы нарушения барьерной функции биологических мембран при патологии
Биологические мембраны выполняют множество функции, нарушение любой из которых может привести к изменению жизнедеятельности клетки в целом и даже к ее гибели. На рис. 5 дано схематическое изображение типичной мембраны с указанием тех ее элементов, повреждение которых может иметь место в патологии и лежать в основе развития различных заболеваний.
Наиболее тяжелые последствия вызывает повреждение липидного слоя (или бислоя) мембраны. Липидный слой цитоплазматической и внутриклеточных мембран выполняет две основные функции - барьерную и матричную (структурную). Повреждение барьера приводит к нарушению регуляции внутриклеточных процес-
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
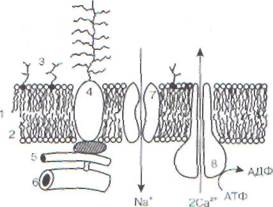
Рис. 5. Элементы биологических мембран, подверженные повреждению: 1 - липидный бислой; 2 - монослой липидных молекул; 3 - гликолипиды; 4 - гликопротеиды; б - микрофиламенты; 6 - микротубулы: 7 - ионный канал; 8 - ионный насос
сов и тяжелым расстройствам клеточных функций.
Изучение воздействия разного рода повреждающих агентов на изолированные клетки (например, эритроциты), митохондрии, фосфолипидные везикулы (липосомы), плоские бислойные липидные мембраны (БЛМ) и другие модельные объекты показало, что в конечном счете существует всего четыре основных процесса, которые непосредственно обусловливают нарушение целостности липидного бислоя в патологии [Владимиров Ю. А., 1973]:
1) перекисное окисление липидов;
2) действие мембранных фосфолипаз;
3) механическое (осмотическое) растяжение мембраны;
4) адсорбция на липидном слое полиэлектролитов, включая некоторые белки и пептиды.
Изучение роли мембран в развитии того или иного патологического состояния предполагает знание химических и физических условий протекания перечисленных выше процессов и результата их действия на мембранные структуры, включая знание молекулярных механизмов действия каждого из них и биологические последствия повреждения мембран для жизнедеятельности клетки и организма в целом.
Механическое (осмотическое) растяжение мембран и адсорбция белков. Важную роль во вторичном повреждении мембран играют процессы их механического растяжения в результате
нарушения осмотического равновесия в клетках. Если поместить эритроциты в гипотонический раствор, то вода будет входить в клетки, они примут сферическую форму, а затем произойдет гемолиз. Митохондрии также набухают в гипотонических средах, но происходит разрыв только внешней мембраны; внутренняя остается целой, хотя теряет способность задерживать небольшие молекулы и ионы. В результате митохондрии не способны к окислительному фосфорилированию.
Сходные явления наблюдаются и в целых клетках и тканях в условиях патологии. Так, в результате активации фосфолипазы мембран митохондрий при гипоксии они становятся проницаемыми для ионов калия. Если в этих условиях восстановить оксигенацию ткани, то на мембранах митохондрий восстановится мембранный потенциал (со знаком «минус» внутри) и митохондрии будут «насасывать» ионы калия, вслед за которыми в матрикс входит фосфат. Концентрация ионов внутри митохондрий возрастает, и органеллы набухают. Это приводит к растяжению мембран и их дальнейшему повреждению.
Механизм нарушения барьерной функции мембраны при адсорбции на липидном бислое полиэлектролитов, в частности белков, чужеродных для клетки, пока изучен недостаточно. В модельных опытах показано, что в некоторых случаях в мембране могут формироваться белковые «поры», а также происходит снижение ее электрической стабильности. Можно думать, что сходные явления имеют место при действии на клетки антител.
Молекулярные механизмы увеличения проницаемости липидного слоя для ионов. При изучении молекулярных основ проницаемости липидного слоя широко используются модельные мембранные системы: изолированные мембранные структуры (эритроциты, митохондрии, везикулы саркоплазматического ретикулума), а также искусственные фосфолипидные мембраны (бимолекулярные липидные мембраны и фосфолипидные везикулы - липосомы). Изучение такого рода систем показало, что сам по себе липидный слой практически непроницаем для ионов. При действии различных химических и физических факторов он становится проницаемым по одной из трех причин (или их комбинаций):
Часть I. ОБЩАЯ НОЗОЛОГИЯ
1. В липидном бислое (вязкость которого внут
ри близка вязкости растительного масла) появ
ляется жирорастворимое вещество, способное
связывать ионы. Механизм переноса ионов в этом
случае напоминает перевоз пассажиров в лодке
с одного берега на другой и называется «челноч
ным», или переносом с помощью подвижного
переносчика.Примером подвижного переносчи
ка может служить ионофорный антибиотик ва-
линомицин, который образует комплекс с иона
ми калия, растворимый в липидной фазе мемб
раны. К числу подвижных переносчиков, воз
можно, относятся водорастворимые продукты
перекисного окисления липидов, в присутствии
которых, как оказалось, увеличивается прони
цаемость мембраны для ионов водорода.
2. В липидном слое появляются вещества,
молекулы которых, собираясь вместе, образуют
канал через мембрану. Сквозь такой канал ионы
могут проходить с одной стороны мембраны на
другую. Каналы образуются молекулами неко
торых антибиотиков, например грамицидина А
иполимиксина. Продукты перекисного окисле
ния липидов также могут образовывать каналы
в липидном слое, если в растворе есть ионы каль
ция. Продукты расщепления некоторых фосфо-
липидов (в частности, кардиолипина) фосфоли-
пазой А2 образуют каналы для одновалентных
катионов.
3. Снижается электрическая прочность липид-
ного слоя мембраны и ее участок разрушается
электрическим током, который возникает под
влиянием разности потенциалов, существующей
на мембране. Такое явление носит название элект
рического пробоя.
Дата добавления: 2015-03-19; просмотров: 1075;
