Принцип методу. Визначення заліза (II) засноване на перебігу в розчині окисно-відновної реакції:
Визначення заліза (II) засноване на перебігу в розчині окисно-відновної реакції:
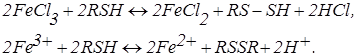
Система 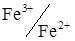 електрохімічно зворотна. У зв'язку з цим навіть при невеликій напрузі на електродах проходять реакції окиснення Fe2+:
електрохімічно зворотна. У зв'язку з цим навіть при невеликій напрузі на електродах проходять реакції окиснення Fe2+:
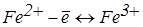 (електрод з більшим значенням Е1);
(електрод з більшим значенням Е1);
і відновлення Fe3+:
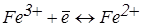 (електрод з меншим значенням Е2).
(електрод з меншим значенням Е2).
Електродні реакції на мікроелектродах – це мікропроцеси. Вони сприяють в амперометричному титруванні фіксації точки еквівалентності. Зміна струму в процесі титрування зворотних систем на 2-х індикаторних електродах розглянута в розділі 6. Для електрохімічних зворотних систем значення Еокисн. і Евіднов. іонів рівні. Напруга, що накладається, витрачається практично на подолання опору ланцюга.
Електрохімічна комірка має вигляд, наданий на рис. 7.27.
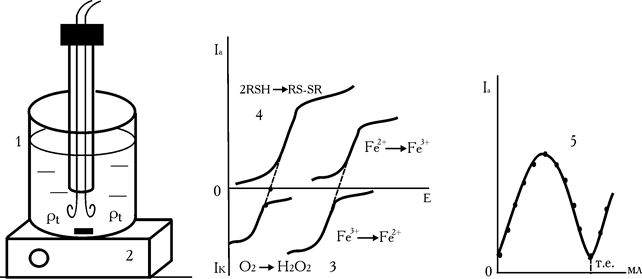
Рис. 7.27. Електрохімічна комірка з двома індикаторними електродами (1); корпус магнітної мішалки (2); катодно-анодні хвилі систем 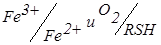 (3, 4); крива титрування Fe3+ – тіооксином
(3, 4); крива титрування Fe3+ – тіооксином
Індикаторні електроди – 2 Pt спіралі. Перемішування проводиться за допомогою магнітної мішалки (1). Тому що змішана окисно-відновна пара: розчинений 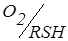 також зворотна (рис. 7.27, кр. 4, то після точки еквівалентності сила струму зростає (рис. 7.27, кр. 5).
також зворотна (рис. 7.27, кр. 4, то після точки еквівалентності сила струму зростає (рис. 7.27, кр. 5).
Як фоновий електроліт використовують 2М HCl. У кислому середовищі дисоціація сульфідної групи подавлена і реакції комплексоутворення з Fe2+ (продуктом реакції) і з багатьма іншими катіонами не проходить. Тому визначення заліза 8-меркаптохіноліном вибіркове.
Необхідні прилади, реагенти і посуд
1. Амперометрична установка з двома платиновими електродами типу БАН-УНІІЗ (рис. 7.28).
2. Мірний циліндр місткістю 50 мл.
3. Мікробюретка 2–5 мл.
4. Стаканчик для титрування місткістю 50 мл.
5. Соляна кислота, 2 М.
6. Розчин 8-меркаптохіноліну, 0,02 М.
7. Аналізований розчин FeCl3.
Дата добавления: 2015-03-19; просмотров: 667;
