Принцип методу. Диетілдитіокарбамінат натрію, як уже відзначалося раніше в роботах 7.5 і 7.6, утворює міцні хелатні сполуки з металами групи сірководню і сірчистого амонію
Диетілдитіокарбамінат натрію, як уже відзначалося раніше в роботах 7.5 і 7.6, утворює міцні хелатні сполуки з металами групи сірководню і сірчистого амонію. У залежності від міцності зв'язків Me–S, добутки розчинності у тіокарбамінатів різні. Наприклад:
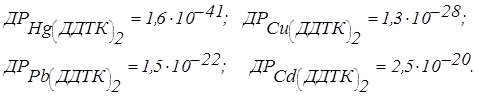
У випадку амперометричного титрування складних розчинів, що містять кілька метало-іонів, реакції перебігають послідовно, але форма кривих не дозволяє для ряду сполучень визначити точки еквівалентності кожного з них, тому що ріст струму спостерігається тільки після появи надлишку титранту, що окиснюється на мікроаноді. Для суміші Hg2++Cu2+, наприклад, першим осаджується дитіокарбамінат ртуті, потім відразу з титрантом реагує мідь. Крива титрування такого сполучення наведена на рис. 7.24, кр. 1.
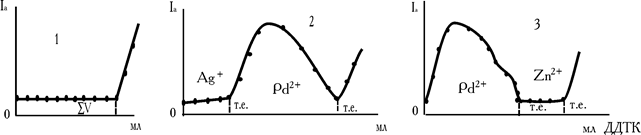
Рис. 7.24. Криві амперометричного титрування бінарних сумішей диетілдитіокарбамінатом натрію: 1 – Hg2++Cu2+, 2 – Аg2++Pb2+, 3 – Pb2++Zn2+
У роботі 7.6 показано, що при взаємодії свинцю (II) із ДДТК фіксується «аномальна» крива за рахунок утворення проміжного розчинного комплексу, що електрохімічно активний (рис. 23). По міцності дитіокарбамінат свинцю займає середнє положення серед різних внутрішньокомплексних сполук цього ряду:
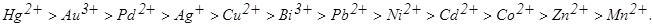
Тому, якщо відтитрувати суміші Ag+–Pb2+ і Pb2+–Zn2+, то на кривих фіксуються дві точки еквівалентності. Срібло (I) реагує з ДДТК першим (рис. 7.24, кр. 2), а цинк – після свинцю (рис. 7.24, кр. 3).
Солі свинцю (II) можна використовувати як амперометричний індикатор, що сприяє підвищенню вибірковості реакції при визначенні металів, які розташовані у ряді міцності лівіше Pb2+ у присутності металів, які розташовані у ряді міцності правіше свинцю. Цей принцип і використовується для аналізу суміші Cu2+ і Cd2+.
Іони міді (II) утворюють із ДДТК малорозчинну сполуку, яка випадає на дно стаканчика у вигляді коричневого осаду (ДР=10-28) (робота 7.5). Іони кадмію дають малорозчинний диетілдитіокарбамінат білого кольору аналогічної будови:
 |
Титрування суміші міді і кадмію у випадку відсутності свинцю дозволяє визначити об’єм ДДТК (VS), що пішов на титрування суми обох металів (рис. 7.25, кр 1). При титруванні міді і кадмію в присутності свинцю відтитровуються всі три метал-іони. Перший перегин на кривій титрування (V1) (рис. 7.25, кр.2) відповідає об’єму ДДТК, що пішов на зв'язування міді. Після Cu2+ з титрантом реагує Pb2+. Проміжна сполука, що утвориться, РbLДДТК+, окиснюється на електроді і «робить» точку еквівалентності міді видимою. Другий перегин на складній кривій виходить нечітким. Значення ДР карбамінатів Pb2+ і Cd2+ близькі 1,5.10-22 і 2,5.10-20 відповідно, і в міру зменшення концентрації Pb2+, два іони осаджуються одночасно. У зв'язку з чим визначити об’єм ДДТК на кадмій важко. Аналіз суміші Cu2+ і Cd2+ проводять таким чином: спочатку відтитровують аналізований розчин без додавання свинцю та одержують сумарний об’єм титранту (VS1). Потім до такого ж аліквотного об’єму задачі додають Pb(NO3)2 і відтитровують тільки мідь. Титрування проводять до першого підйому струму (V1). Об’єм ДДТК, витраченого на кадмій, знаходять за різницею
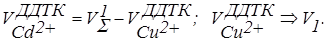
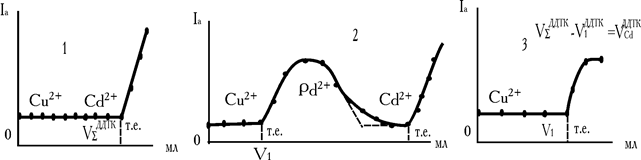
Рис. 7.25. Криві амперометричного титрування міді і кадмію одночасно присутніх у розчині диетілдитіокарбамінатом: 1. – Cu2++Cd2+ без додавання Pb2+; 2. – Cu2+ і Cd2+ у присутності Pb2+; 3 – визначення Cu2+ у присутності Cd2+ і доданого Pb(NO3)2
Робота складається з наступних етапів:
1. Визначення титру 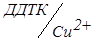 .
.
2. Визначення титру 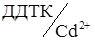 .
.
3. Титрування аліквотного об’єму аналізованої задачі, в яку доданий Pb(NO3)2 з метою визначення VДДТК витраченого тільки на Cu2+.
4. Титрування такого ж аліквотного об’єму аналізованої задачі без додавання Pb(NO3)2 з метою визначення VДДТКS, що пішов на реакцію з Cu2+ і Cd2+.
5. Розрахунки: 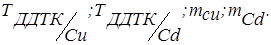
Необхідні прилади, реактиви і посуд
1. Амперометрична установка, Pt обертовий індикаторний електрод і каломельний електрод порівняння.
2. Мірний циліндр місткістю 50 мл.
3. Мікробюретка 2–5 мл.
4. Стаканчик для титрування місткістю 50 мл.
5. Мірна колба на 100 мл.
6. Піпетки на 5 і 10 мл.
7. Стандартний розчин Cu(NO3)2, 0,002 М.
8. Стандартний розчин Cd(NO3)2, 0,002 М.
9. Стандартний розчин Pb(NO3)2, 0,001 М.
10. Розчин хлористого калію, 0,1 М.
11. Аналізований розчин суміші солей Cu(NO3)2 і Cd(NO3)2.
Дата добавления: 2015-03-19; просмотров: 709;
