ЗАГАЛЬНІ ВІДОМОСТІ
Синдромы диагностируются при возникновении нейроэктодермальных опухолей или гиперплазии в более чем двух эндокринных железах. Обычно такие синдромы считаются семейными с аутосомно-доминантным типом наследования. Они различаются по характеру и числу сочетанных поражений желез, но объединяющим признаком является их происхождение из единого для всей эндокринной системы и APUD-системы зачатка – эктодермы, с возможным возникновением дедифференцированной клетки-предшественницы.
В настоящее время выделены 4 основных синдрома множественных эндокринных опухолей.
I тип. Синдром Вернера.
Включает:
· опухоли паращитовидных желез (гиперпаратиреоз);
· опухоли островковой ткани поджелудочной железы (инсулинома, глюкагонома, гастринома, ВИПома и др.);
· опухоли гипофиза (соматотропинома, пролактинома, кортикотропинома).
IIа тип. Синдром Сиппла
Его компоненты:
· медуллярный рак щитовидной железы;
· феохромоцитома;
· гиперпаратиреоз.
IIб тип.
В дополнение к компонентам синдрома Сиппла включает нейромы слизистых оболочек, нейропатию, патологию мышц и скелета.
III тип.
Компонентами этого типа являются:
· гиперпаратиреоз;
· феохромоцитома;
· карциноид двенадцатиперстной кишки.
Ранняя диагностика столь сложных полиэндокринопатий улучшает возможность лечения и прогноз этих тяжелых заболеваний.
ЗАГАЛЬНІ ВІДОМОСТІ
Амперометричне титрування є титриметричним методом аналізу, в якому для індикації точки еквівалентності використовують струм, що виникає в ланцюзі за рахунок розряду іонів, які беруть участь у титруванні (визначуваного компонента, надлишку титранта) або продуктів їх взаємодії. Амперометричне титрування являє собою модифікацію полярографічного методу аналізу, заснованого на пропорційності дифузійного граничного струму від концентрації речовини, що приймає участь в електродній реакції і що обумовлює зміни граничного дифузійного струму, який і є аналітичним сигналом у розглянутому методі аналізу.
Безпосередній зв'язок між амперометричним титруванням і полярографічним методом краще за все проілюструвати наступним прикладом. Для ряду розчинів солі Мору, (NH4)2Fe(SO4)2, з різною концентрацією зняті вольтамперні криві (рис. 1.1). Залізо (II) окиснюється на Pt мікроелектроді. На кривих фіксуються полярографічні хвилі. Чим більше концентрація Fe2+ у вихідному розчині, тим вище граничний дифузійний струм. Для амперометричних титрувань заліза (II) біхроматом калію:
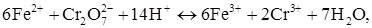
на електроди накладається напруга, відповідна положенню цих площадок щодо осі абсцис (Е), наприклад +1 В (див. рис. 1.1) і відтитровують розчин з максимальним вмістом Fe2+ розчином біхромату калію. При додаванні титранту концентрація заліза (II) і сила дифузійного струму симбатно зменшуються (рис. 1.2). У кінцевій точці титрування встановлюється постійний залишковий струм, величина якого надалі практично не змінюється.
Рис. 1.1. Графічне зображення зв'язку між полярограмами (вольтамперними кривими) (1) і кривими амперометричного титрування (2, 3)
У випадку титрування K2Cr2O7 розчином солі Мору при такій же напрузі, титрант (Fe2+) витрачається на хімічну реакцію і сила струму, поки в розчині є біхромати-іони, не змінюється (рис. 1.3). Після точки еквівалентності з'явиться надлишок заліза і струм різко зросте. Підйом струму, що спостерігається після точки еквівалентності, пропорційний кількості надлишку титранту. За витраті стандартного розчину титранту (перетинанням двох прямих) знаходять графічним методом точку еквівалентності і розраховують масу визначуваної речовини або її масову частку, використовуючи знайомі для титриметрії розрахункові формули:
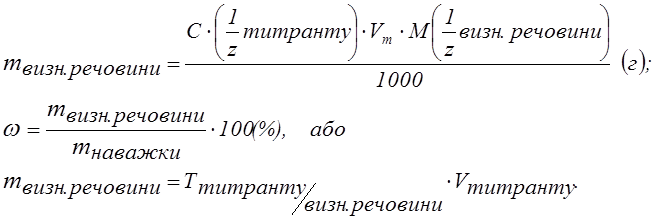
Можливості амперометричного титрування значно ширші, ніж полярографічного аналізу. У полярографії електродну реакцію повинний давати визначуваний іон. У той час як в амперометрії електрохімічно активними можуть бути не тільки визначуваний компонент, але і розчин, яким титрують, або продукт хімічної реакції, що виділяється. Ширше і діапазон визначаємих концентрацій.
Так само як і в полярографії при амперометричному титруванні використовують мікро- і макроелектроди. При анодній поляризації як мікроелектроди частіше застосовують Pt, рідше графіт, срібло або золото. У випадку катодної поляризації – ртутно-крапельний або амальгамований електроди. Макроелектродом слугує каломельний або хлоросрібний електрод. Робочі електролітичні комірки мають вигляд:
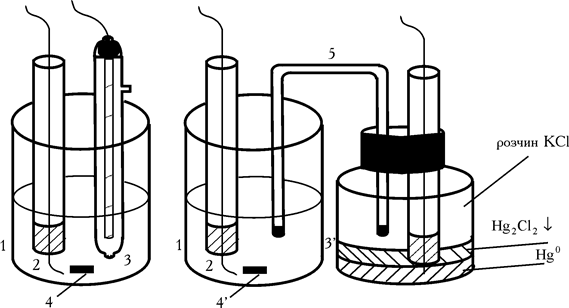
Рис. 1.2. Електролітичні комірки з одним індикаторним електродом: 1 – стаканчик для титрування; 2 – платиновий мікроелектрод; 3 і 3’ – макроелектроди хлоросрібний і каломельний відповідно; 4 – мішалка; 5 – електролітичний ключ
Для виконання аналізу амперометричним методом необхідне виконання наступних двох основних умов:
1. У розчині кількісно, швидко і селективно повинна проходити хімічна реакція. Запишемо її в загальному вигляді таким чином:
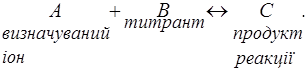
2. Один з компонентів (А, В або С) повинний бути електрохімічно активним. Тобто при напрузі, що накладається, іони (молекули) А, В або С повинні давати електродну реакцію. Вони повинні окиснюватися або відновлюватися на мікроелектроді.
Для проведення аналізу звичайно спочатку знімають вольтамперні криві А, В та С, якщо електрохімічні властивості їх невідомі або не дані в прописах. Для цього в розчини перерахованих речовин опускають електроди, і змінюючи напругу, що накладається, від 0 до +1,2 В (відн. НКЕ) або до – 1,0 В, записують виникаючу силу струму в ланцюзі. Вибирають напругу, що відповідає середині інтервалу значень Е, площадки граничного дифузійного струму (рис.1.1). Накладають цю напругу на електроди. Занурюють електроди в аналізований розчин і проводять титрування, записуючи силу струму після кожного додавання титранту (по 0,1–0,2 мл). Титрування закінчують після різкої зміни струму (рис.1.2) або, якщо ця зміна почалася з початку титрування, то після встановлення значень, що не змінюються. (рис. 1.3).
Амперометричне титрування проводять на приладах АУ-4М, БАН-УНІІЗ і звичайних полярографах. Іноді для аналізу застосовують установки, зібрані безпосередньо в лабораторіях. Схема такої установки надана на рис.3.
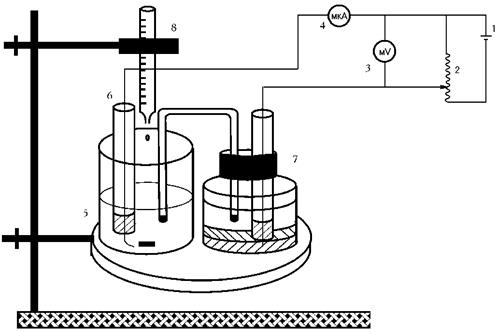
Рис. 3. Схема амперометричної установки: 1 – джерело постійного струму – батарейка;
2 – дільник напруги; 3 – мілівольтметр; 4 – мікроамперметр; 5 – електролітична комірка;
6 – обертовий платиновий мікроелектрод; 7 – каломельний електрод; 8 – мікробюретка для титрування
Для виготовлення платинового мікроелектрода Pt дріт впаюють у скляну трубку, в яку для контакту насипають графіт і занурюють звичайний дріт-провідник, який і підключають у ланцюг.
За допомогою амперометричного титрування можуть бути визначені практично всі елементи періодичної системи Д.І. Менделєєва. Останнє наочно проілюстроване складеними рядами катіонів і аніонів, що розташовані в порядку відповідним періодичним групам таблиці:
I. AuCl4– і AuCl2–, Ag+, Cu2+ і Cu+, K+, Na+, Li+;
II. Be2+, Ba2+, Ca2+, Mg2+ Cd2+, Zn2+, Hg2+ і Hg22+;
III. Al3+, In3+, Ga3+, Tl3+ і Tl+, Y3+, Sc3+, B(H3BO3), Ce4+ і ін. латаноїди, актиноїди – уран, торій, плутоній;
IV. Pb2+, SnCl62– і SnCl42–, германій, цирконій, гафній, Si (SiО32–, кремніймолібденові і кремнійвольфрамові кислоти);
V. V (VO3–, VO2+, V3+), Bi3+, Sb (SbCl6– і SbCl4–), As (AsО43– і AsО33–), Nb і Ta (Me(C2O4)n–m); P(PO43–), N2(NH3, NO2–, NO3–, H4N2 та ін.);
VI. Mo (MoО42–, MnО22+, MoIII), W (WO42–), Cr (Cr2O72–, Cr3+), O2 (OH–, озон, Н2О2); Se і Te (VI і IV); S (S2–, SO32–, S2O32–, CNS–, полісульфіди);
VII. F–, Cl–, Br–, I–, Mn (MnО4–, Mn2+, Mn3+Ln–, Mn2+), Tc і Re (MeО4–);
VIII. Fe3+ і Fe2+, Ni3+ і Ni2+, Co3+ і Co2+, PdCl42–, JrCl62–, PtCl42–, Os і Ru (VI, IV, III), Rh (III і V).
Згідно з наведеними даними за допомогою амперометричного титрування можливе і визначення елементів різного ступеня окиснювання.
Металоїди (неметали) при розкритті наважок в основному переводять у кисневмісні аніони.
Амперометричним титруванням можна також визначати багато органічних сполук. Вибір титранту носить індивідуальний характер. Часто зустрічаються нітрати срібла і ртуті, сульфати міді, кадмію і церію, біхромат калію, бромат-бромідна і йодат-йодидна суміші, K3Fe(CN)6, солі хрому (II), гідроксиламін та ін.
Дані за аналізом органічних сполук, амперометричним титруванням надані в табл.1.1
Як видно з наведених даних визначення можливе для сполук різних класів: альдегідів, кетонів, спиртів, кислот, амідів і амінів, насичених, ненасичених і ароматичних вуглеводнів, білків, алкалоїдів та інших сполук.
Таблиця 1.1
Дата добавления: 2015-03-19; просмотров: 790;
