ГЛАВА 78. ОСНОВЫ НЕОПЛАЗИИ
Джон Мендельсон (John Mendelsohn)
Введение. Последние годы отмечены значительным прогрессом в понимании биологических и биохимических основ развития рака. Однако это не означает, что проблема неопластических заболеваний решена. Успехи в лечении рака у взрослых приходили постепенно и касались в основном злокачественных опухолей, характеризующихся необычно высокой чувствительностью к лучевому воздействию и химиотерапии. Они включают прежде всего острый миелоцитарный лейкоз — лимфопролиферативные злокачественные заболевания, рак яичка и молочной железы. Новые способы лечения, включая иммунотерапию и применение веществ, способствующих нормальному созреванию клеток, пока остаются на стадии экспериментов и интенсивного изучения. Между тем начаты поиски соединений, способных взаимодействовать с продуктами онкогенов, генными регуляторами, факторами роста и их рецепторами. Исследования с применением современных методов молекулярной генетики и иммунологии способны обеспечить создание новой группы противораковых веществ, которые в свою очередь могут быть быстро подвергнуты клиническим испытаниям. Такие разработки представляются возможными, поскольку понимание рака как патологического процесса подкрепляется новыми знаниями о нем как о приобретенном генетическом нарушении.
Это глава представляет собой обзор биологии, этиологии и клинических проявлений неопластического процесса, вслед за которым дается описание общепринятых методов диагностики рака, определения его стадии или степени распространенности процесса. Лечение рака описывается в последующей главе, а детали ведения больных определенными формами злокачественных опухолей будут приведены в главах, посвященных поражениям различных органов.
Определение понятия. Термины «рак», «неоплазия» и «злокачественность» широко употребляются как в специальной, так и в популярной литературе. Заболевание, именуемое раком, наиболее полно определяется четырьмя характерными чертами, которые отличают раковые клетки от их нормальных аналогов.
1. Клональность: в большинстве случаев раковая опухоль возникает из единственной стволовой клетки, пролиферирующей с образованием клонов злокачественных клеток.
2. Автономия: рост опухолевых клеток не регулируется должным образом нормальными биохимическими и физическими влияниями со стороны окружающей среды.
3. Анаплазия: отсутствие нормальной координированной клеточной дифференцировки.
4. Метастазирование: раковые клетки приобретают способность к неограниченному росту и диссеминации в другие органы и ткани.
Аналогичные свойства могут проявляться и у нормальных неопухолевых клеток в определенные периоды их жизненного никла, например в ходе эмбриогенеза и репаративной регенерации, но у раковых клеток эти признаки неадекватны или чрезмерно выражены. Процесс, в ходе которого нормальная клетка приобретает указанные черты, называется злокачественной трансформацией.
Таблица 78-1. Оценка количества новых выявленных случаев заболеваний и смертности для рака наиболее часто встречающихся локализаций (1984 г.)
| Место возникновения или тип опухоли | Количество случаев | Количество смертельных исходов |
| Легкое | 139 000 | 121 000 |
| Толстая и прямая кишка | ||
| Молочная железа | ||
| Предстательная железа | ||
| Матка | 55 000' | |
| Мочевые пути | ||
| Полость рта | 27 000 | |
| Поджелудочная железа | ||
| Лейкозы | ||
| Яичники | ||
| Меланома | 180002 |
Включая шейку матки; если суммировать указанное в таблице число случаев с числом рака in situ, то общее число составит 99 000.
2 Оценка количества новых выявленных случаев рака кожи (исключая меланому) около 400 000.
Примечание. Оценка количества наблюдений основана на данных N. С. I. Seer programm 1973—1979 гг.
Клинические аспекты. Одна треть всего населения США находится под угрозой поражения раком. Средняя пятилетняя выживаемость для этих больных (вероятность отсутствия смертельного исхода от рака в течение 5 лет с момента установления диагноза) увеличилась почти до 50% в результате улучшения ранней диагностики и успехов в лечении этого заболевания. Однако рак продолжает занимать второе место среди причин смерти в этой стране, уступая только сердечно-сосудистым заболеваниям. Около 20% американцев умирают от рака, в 1984 г. это составило 450 тысяч случаев. Половина смертельных исходов связана с тремя наиболее часто встречающимися локализациями опухолей: легкое, молочная железа и толстая кишка. Раком легкого чаще болеют мужчины, в то время как рак молочной железы является наиболее частой формой злокачественных опухолей у женщин. Рак толстой кишки встречается одинаково часто у мужчин и женщин. Ежегодно Американское противораковое общество представляет суммарные данные о частоте и уровне смертности при наиболее часто встречающихся типах рака. В табл. 78-1 и на рис. 78-1 представлена лишь небольшая часть доступных сведений об их распространенности. Особого внимания заслуживают данные (см. рис. 78-1) о повышении смертности от рака легкого по сравнению со стабильными или снижающимися цифрами, характеризующими смертность от других злокачественных заболеваний.
Обычно рак представляется врачу как очаг патологического роста тканей или опухоль, которая вызывает недомогание, обусловленное продукцией биохимических активных молекул, местного распространения или инвазии в прилежащие или отдаленные ткани. Симптомы заболевания зависят от характера продуцируемых опухолью молекулярных продуктов и локализации(и) опухолевого процесса. Каждый тип рака характеризуется вполне определенным течением заболевания, лежащим в основе вероятных клинических проявлений конкретного опухолевого процесса. Выбор надлежащего плана лечения для каждого больного злокачественной опухолью зависит от выявленной степени распространенности опухолевого процесса, представлений о его клиническом течении и возможных методах лечения для каждого типа рака.
Биология и биохимия опухолевой клетки. Поскольку все клетки организма происходят из единственной оплодотворенной яйцеклетки, все они несут одинаковую генетическую информацию. Пролиферация и дифференцировка этой клетки в эмбрион, а в конечном итоге — зрелый организм, базируется на избирательной и координированной реализации геномного набора.
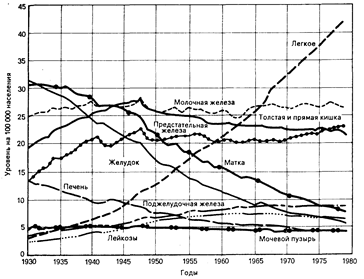
Рис. 78. Уровни смертности от рака различной локализации в США 1930— 1979 гг. (подготовлено Американским противораковым союзом по данным Национального центра статистики здоровья и Бюро переписи).
Контроль за экспрессией генов осуществляется посредством недостаточно известных молекулярных взаимодействий, которые могут быть частично изменены путем химических воздействий со стороны микроокружения. Геномный набор включает информацию, позволяющую клеткам клонально размножаться, функционировать с различной степенью автономии, дифференцироваться и дедифференцироваться, мигрировать от одной части тела к другой. Во взрослом организме процессы раневого повреждения и заживления активируют проявление свойств этих клеток в «эмбриональноподобной» форме, но под хорошо координированным контролем. При злокачественной трансформации нормальный процесс контроля извращается или отсутствует в результате аномального действия особой группы генов (онкогенов), которые имеют ведущее значение в регуляции клеточной активности. Детальное обсуждение онкогенов представлено в гл. 59.
Клональность. Тщательный цитогенетический анализ хромосом раковых клеток в стадии метафазы принес богатую информацию о неопластическом процессе. Стало ясно, что фактически все солидные опухоли и большинство новообразований гематопоэтической системы характеризуются нарушениями кариотипа, наследуемыми популяцией опухолевых клеток. Это может сопровождаться транслокацией фрагментов хромосом в другие участки, добавлением или исчезновением частей хромосом или целых хромосом. У значительной части больных с определенной формой рака нередко возникает серьезное повреждение кариотипа. Первым и наиболее хорошо известным примером такого нарушения является филадельфийская хромосома (РП), выявляемая у 85% больных хроническим миелолейкозом (ХМЛ), при котором длинное плечо хромосомы 22 транслоцировано в длинное плечо хромосомы 9. Это повреждение настолько характерно для ХМЛ, что выявление идентичной транслокации при анализе некоторых случаев острого лимфоцитарного лейкоза было интерпретировано как свидетельство необычной конверсии ХМЛ (как правило, ХМЛ прогрессирует в сторону острого миелоцитарного лейкоза). Характерные перестройки хромосом описаны и при ряде других форм рака у человека.
Выявление однотипных нарушений кариотипа во всех клетках опухоли является важным доказательством клепального происхождения новообразований. В свою очередь хромосомные нарушения служат маркерами злокачественного перерождения конкретных клеток.
Было показано удивительное соответствие между локализацией в хромосоме некоторых клеточных онкогенов и точками разрыва, выявленными при хромосомных транслокациях в злокачественных опухолях у человека. Кроме того, во многих случаях эти локусы коррелировали со «слабыми» точками в хромосоме. Воздействие на культивируемые клетки веществами, подавляющими репарацию ДНК, приводит к частым разрывам хромосом именно в этих точках. Обсуждаемая в настоящее время вполне обоснованная гипотеза связывает эти феномены воедино и предполагает, что перестройки хромосом могут приводить к активации клеточных онкогенов. Например, при лимфоме Беркитта типичная транслокация между хромосомами 8 и 14 ставит клеточный онкоген туе рядом с локусом цепочки тяжелых иммуноглобулинов, местом генной активации нормального лимфоцита.
Исследования избирательной экспрессии Х-связанных изрэнзимов глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) у гетерозиготных больных дали новые свидетельства клонального происхождения большинства типов раковых опухолей из одних и тех же материнских клеток. Исследование изоэнзимов Г-6-ФД и кариотипов у больных ХМЛ выявило клональные нарушения в эритроидных, миелоидных и мегакариоцитарных клетках, как и в В-лимфоцитах, что позволило предположить происхождение данного вида злокачественного поражения из клетки-предшественника, общего для всех этих клеточных линий.
Хотя имеются убедительные доказательства возникновения рака вследствии генетических повреждений одной клетки, кроме того, достаточно часто отмечаются наследственные нарушения, приводящие к образованию комплекса гетерогенных субклонов в популяции зрелых опухолевых клеток. Последняя пролиферирует в достаточной степени для клинического выявления опухоли. Эта гетерогенность может быть показана при анализе всего разнообразия признаков, характеризующих субпопуляции клеток в пределах одной опухоли. Например, дальнейшие нарушения кариотипа, различная чувствительность к воздействию лекарственных препаратов, неодинаковая способность к метастазированию, скорости роста, наличие или отсутствии гормональных рецепторов или особых гликопротеинов клеточной поверхности. Поэтому с течением времени прогрессивное накопление наследственных нарушений в субпопуляциях опухолевых клеток обычно приводит к значительным изменениям фенотипа. Клиническим эквивалентом последних является развитие резистентности по отношению к ранее эффективным лечебным воздействиям или дальнейшее прогрессирование метастатического процесса. Появление новых хромосомных нарушений у больных ХМЛ с наличием хромосомы Рп" означает начало быстрого прогрессирования опухолевого процесса фатальной фазы заболевания. Схематическая модель процесса клональной прогрессии представлена на рис. 78-2. Остается определить, когда в ходе развития типичного злокачественного новообразования наступает процесс клональной прогрессии: ряд генетических повреждений может возникать на ранних этапах с более поздним распространением отдельных субпопуляций из гетерогенной смеси клеток по мере изменения условий; и, наоборот, могут иметь место генетические нарушения с очень коротким временным интервалом между их возникновением и выявлением на основе изменений в поведении опухолевых клеток. Вслед за открытием клеточных онкогенов быстро накопились свидетельства, позволяющие полагать, что последовательная активация двух или более таких генов может составлять основу молекулярно-генетической теории клональной прогрессии субпопуляции опухолевых клеток. Кроме транслокации, активация клеточных онкогенов может быть результатом действия ряда других генетических механизмов. Эти механизмы включают амплификацию генов или прикрепление активатора транскрипции, прилежащих к цнс или находящихся в транссвязи с клеточным онкогеном в присутствии или в отсутствие сопутствующих мутаций специфических нуклеотидов в цепочке ДНК онкогенов. Многие из этих изменений не выявляются в кариотипе, но их можно идентифицировать посредством специального анализа расщепленной клеточной ДНК или разложения ДНС.
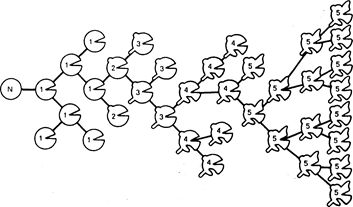
Рис. 78-2. Схематическая модель клональной прогрессии. N-клетка является нормальной. Отмечены пять гипотетических генетических изменений:
1 — не приводит к малигнизации; 2 — вызывает малигнизацию, 3 — прибавляет свойство инвазивности; 4 — обусловливает способность к диссеминации и образованию метастазов и 5 — вызывает резистентность к химиотерапии. Каждое из этих изменений может сопровождаться инкреминированными нарушениями кариотипа с возрастающей склонностью к анеуплоидии в процессе последующей клональной эволюции.
Автономия. Влияние факторов среды, регулирующих пролиферацию нормальных клеток, при возникновении злокачественной трансформации извращается. Это демонстрируется рядом экспериментальных воздействий, которые так или иначе свидетельствуют о сохранении злокачественными клетками способности к пролиферации в условиях, рассматриваемых обычно как неблагоприятные (табл. 78-2).
По крайней мере на начальных этапах опухолевого роста автономия злокачественных новообразований у человека представляется скорее относительной, чем абсолютной. Хорошо известные эксперименты Huggins с сотр. в 50-х годах привели к возникновению нового подхода к лечению рака, который предусматривал изначальную зависимость некоторых опухолей от обычных воздействий половых гормонов. Конверсия многих форм рака предстательной и молочной желез от чувствительности к резистентности в ходе гормональной терапии наглядно демонстрирует дальнейшее развитие автономии посредством клональной прогрессии.
Таблица 78-2. Экспериментальное обнаружение злокачественной трансформации
| Характер оценки | Нормальная клетка | Трансформированная клетка |
| Способность отдельных клеток к формированию колоний в агаровой суспензии | Ограниченная | Имеется |
| Выраженная зависимость замедления клеточной пролиферации в жидкой | Имеется | Отсутствует |
| культуре от плотности культуры | ||
| Генерации клеток, возникающие в результате непрерывного деления в жидкой культуре | Не более 50 | Неограниченны |
| Потребность в сыворотке крови или факторах роста | Постоянная | Уменьшена или отсутствует |
| Способность к независимому росту | Отсутствует | Имеется |
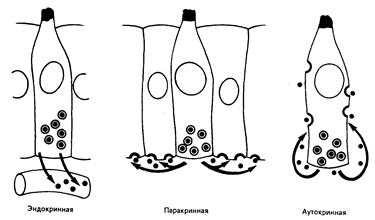
Рис. 78-3. Схематическое изображение аутокринной, паракринной и эндокринной секреции.
Пептидные факторы роста показаны в латентной форме внутри клетки. Утолщенные полукруглые участки клеточной мембраны представляют собой рецепторные зоны (из М. В. Sporn, G. J. Tobaro — New Engl. J. Med., 1980, 303, 878).
Многие линии опухолевых клеток могут пролиферировать в культуральной среде без обычных компонентов сыворотки крови при условии, что к'ней добавляется «коктейль», содержащий от трех до пяти факторов роста и другие стимулирующие рост клеток вещества. Примерами таких факторов являются эпидермальный фактор роста, тромбоцитарный фактор роста, белковый носитель трансферрина и инсулин. Однако для развития злокачественных клеток присутствие этих весьма существенных факторов не обязательно. В экспериментальных условиях был обнаружен механизм, возможно имеющий и клиническое значение, базирующийся на продукции фактора роста (или его аналога) самими опухолевыми клетками. Этот процесс получил название аутокринной секреции. В этом случае гликопротеин, секретируемый опухолевыми клетками, оказывается способным связываться с рецепторами на поверхности опухолевых клеток, что приводит к аутостимуляции (рис. 78-3). Первый аутокринный фактор опухолевого роста, на котором следовало бы остановиться, это трансформирующий а-фактор роста, аналог эпидермального фактора роста. В других случаях опухолевая клетка может активировать внутренний биохимический процесс, обычно зависящий от связывания специфического фактора роста с рецептором клеточной поверхности, тем самым полностью снимая необходимость присутствия стимулирующего рост агента.
Анаплазия. Отсутствие нормальной дифференцировки опухолевых клеток служит критерием, наиболее часто применяемым в диагностике злокачественности опухолевого процесса. Раковым клеткам присущи некоторые морфологические признаки нормальных зрелых аналогов. В то же время при исследовании опухолей с помощью светового микроскопа легко обнаружить отклонения структуры как на уровне отдельных клеток, так и их скоплений. Для них характерны крупные ядра с более структурированным хроматином и четко сформированными ядрышками. Здесь определяются увеличенное количество митозов, в том числе и патологических, и гигантские опухолевые клетки, содержащие несколько ядер, что свидетельствует об анеуплоидии и/или нарушениях кариокинеза. Выраженность морфологических изменений обычно коррелирует со степенью распространенности опухолевого процесса или метастатическим потенциалом опухоли. Гистологическая картина злокачественности характеризуется картиной беспорядка с частичной или полной утратой нормальной архитектоники субстрата. Однако можно полагать, что даже в малодифференцированных злокачественных новообразованиях возможно формирование структур, напоминающих железы или ворсинки.
На биохимическом уровне анаплазия сопровождается продукцией гормонов или связанных с гормонами пептидов, которая либо извращенно регулируется нормальными механизмами обратной связи (например, избыточная продукция кортикостероидов опухолевыми клетками рака коры надпочечников), либо несвойственна этому типу клеток при условии их нормальной дифференцировки (например, продукция АКТГ клетками рака легкого). В подобных случаях геномный набор опухолевых клеток- реализуется несвойственным образом. Другим примером является нерегулируемое образование иммуноглобулина (частичная или полная цепочки) неонластическими дериватами В-лимфоцитов.
Гистологические признаки аномального характера, не согласующиеся с критериями анаплазни (утрата дифференцировки), описываются под названием диспластических. Подобные изменения могут обнаруживаться при пред-раковых состояниях, например, в эпителиальной выстилке бронхов курильщиков сигарет. Эти нарушения часто обратимы. Прекращение курения может привести к нормализации легочного эпителия через 5 лет.
Метастазироваиие. Этот термин объединяет ряд фенотипических признаков, совокупность которых и составляет осложнение, наиболее часто ведущее к смерти больного при раке. Клетки утрачивают способность к сцеплению и точное положение в организованной ткани, мигрируют к близлежащим участкам, приобретают способность к проникновению в кровеносные сосуды и выходу из них, к пролиферации в несвойственном для них месте и среде обитания. Эти изменения сопровождаются биохимическими нарушениями, способствующими метастатическому процессу. Инвазивные опухоли могут секретировать ряд энзимов, разрушающих ткани, включая коллагенааы и лизосомные гидролазы. Кроме того, продуцируются активаторы плазминогена, способствующие фибронолизу. В противоположность этому на тех стадиях, когда образование очага опухолевых клеток может иметь значение для их выживания, в окружающую среду могут высвобождаться прокоагулянтные соединения. В экспериментальных условиях, когда опухолевые клетки проявляют склонность к избирательному поражению некоторого органа как предпочтительного очага метастазирования, представляется, что молекулы поверхности метастатических клеток обнаруживают высокую степень сродства к эндотелиальным клеткам сосудистого русла органа-мишени. В процесс развития опухоли от гомогенного пролиферирующего клона до группы гетерогенной субпопуляции клеток вовлечен целый ряд биохимических превращений. Некоторые из этих популяций прогрессивно накапливают целый спектр энзимов и молекул поверхности, необходимых для реализации процесса метастазирования. Возможно именно по этой причине на ранних этапах опухолевого роста частота метастазирования низка, несмотря на высвобождение из опухоли в общую циркуляцию злокачественных клеток в большом количестве и на протяжении длительного периода. Вещества, способные блокировать критические моменты в процессе метастазирования, имели бы огромное значение в арсенале противоопухолевых средств, доступных для врача.
Представляется, что клональная прогрессия опухоли вызывает такие биохимические или функциональные сдвиги, которые приводят к большей автономии, более высоким степеням анаплазии и большей способности к метастазированию. Вследствие прогрессивного характера селекции клеток с повышенной способностью к образованию опухоли, процесс получил название клональной эволюции. По своему значению этот процесс вполне сопоставим с дарвинской теорией эволюции, но в данном случае все указанные изменения происходят на клеточном уровне.
Этиология, Частота рака варьирует в зависимости от пола, расовой принадлежности и географического местонахождения индивида. Кроме того, типы наблюдаемых опухолей различаются в зависимости от возраста. Некоторые особенности частоты неопластических заболеваний объясняются наследственными чертами и изменениями внутренней среды и микроокружения клеток. Эпидемиологические исследования показывают, что характер питания и воздействие химических и физических факторов окружающей среды также вносят свой вклад в процесс развития опухоли. Факторы среды, оказывающие влияние на частоту рака, распределяются в виде трех больших групп: радиация, химические вещества, вирусы.
Дата добавления: 2015-03-17; просмотров: 1264;
