Методики
Катетеризация правых отделов сердца. Катетеризация правых отделов сердца в настоящее время является хорошо отработанной и безопасной манипуляцией. Под местной анестезией у больного открывают доступ к передней локтевой или большой бедренной венам и вводят длинный гибкий рентгеноконтрастный катетер. Существует и другая методика, в соответствии с которой используют чрескожный доступ. Иглой пунктируют бедренную, внутреннюю или другую вену, затем в нее вводят тонкую гибкую проволоку-проводник, по которой проводят расширитель, а затем канюлю. Проволоку-проводник удаляют, а через канюлю катетер проводят последовательно в правое предсердие, правый желудочек, легочную артерию, до положения заклинивания. При невозможности выполнить флюороскопию (у постели больного, в операционной, палате интенсивной терапии) используют плавающий катетер с баллончиком. Его вводят в выделенную вену под контролем зрения и продвигают вперед, ориентируясь на основании тактильных ощущений, до тех пор, пока глубина, на которую введен катетер, не позволит предположить, что он находится около правого предсердия. Затем регистрируют внутрисердечное давление. Если кривая соответствует локализации катетера в правом предсердии, то баллончик раздувают. По мере дальнейшего продвижения с током крови катетер попадает в полость правого желудочка, легочную артерию и ветви легочной артерии второго и третьего порядка, где и происходит регистрация кривой давления заклинивания. Кроме того, если катетер снабжен термистором, то, используя метод разведения индикатора, можно повторно измерять сердечный выброс. Этот метод описывается далее в этой главе.
Контролируя путь движения катетера по правым отделам сердца методами флюороскопии или киноангиографии, можно получить ценную информацию, позволяющую диагностировать некоторые врожденные пороки развития. Катетер может попасть в добавочную легочную вену или левую верхнюю полую вену. Он может пройти непосредственно через открытый артериальный проток или дефект межпредсердной перегородки. Проникновение катетера из полости правого желудочка в аорту служит признаком дефекта межжелудочковой перегородки или одного из вариантов транспозиции крупных сосудов.
Катетеризация левых полостей сердца. Для катетеризации левых отделов сердца были предложены различные методы, каждый из которых применяется с определенной целью. В настоящее время наиболее широко для введения катетера в восходящий отдел аорты, полость левого желудочка и, реже, левого предсердия используют ретроградный артериальный доступ. Катетер обычно вводят чрескожно в бедренную артерию или через небольшой разрез непосредственно в выделенную плечевую артерию. В тех случаях, когда имеется тяжелая обструкция клапана аорты, обструктивная гипертрофическая кардиомиопатия или механический протез клапана аорты, можно воспользоваться транссептальным доступом к левому предсердию и левому желудочку. При этом катетер вводится через правую большую подкожную вену бедра или бедренную вену так, чтобы его кончик располагался в правом предсердии. Затем через катетер проводят длинную иглу с закругленным концом, которую используют для пункции интактной межпредсердной перегородки в области овального отверстия. По игле катетер вводят в полость левого предсердия, а затем через левый предсердно-желудочковый (митральный) клапан в левый желудочек.
Другие методы катетеризации левых отделов сердца используют реже. При переднем чрескожном доступе иглу вводят непосредственно в полость левого желудочка в области верхушки сердца. Эта манипуляция бывает оправдана при необходимости измерения давления в левом желудочке у больных со стенозом клапана аорты или после операции протезирования клапана аорты и левого предсердно-желудочкового (митрального) клапана.
Ангиография полостей сердца. Ангиокардиография. Правые отделы сердца. Во время катетеризации полостей сердца можно осуществить селективное введение рентгеноконтрастных веществ в те или иные отделы. Контрастирование верхней или нижней полых вен целесообразно выполнять с целью выявления утолщения стенки правого предсердия при констриктивном перикардите или некоторых врожденных пороках, таких как аномалия Эбштейна и атрезии правого предсердно-желудочкового (трехстворчатого) клапана (гл. 185).
Селективная вентрикулография правого желудочка применяется для диагностики недостаточности правого предсердно-желудочкового клапана (трикуспидальной недостаточности) и таких врожденных болезней сердца, как стеноз легочного ствола и тетрада Фалло. Введение контрастного вещества в основной ствол легочной артерии позволяет визуализировать тромбоэмболии легких, врожденные стенозы ветвей легочной артерии, патологические соединения легочных вен. Наблюдение за пассажем контрастного вещества в левофазе позволяет обнаружить опухоли или тромбы внутри левого предсердия.
Левые отделы сердца. Селективную вентрикулографию левого желудочка применяют при диагностике врожденных и приобретенных нарушений, затрагивающих левый предсердно-желудочковый (митральный) клапан и путь оттока крови из левого желудочка, а также для оценки адекватности функции левого желудочка. Стеноз левого атриовентрикулярного отверстия (митральный стеноз) сопровождается утолщением и/или кальцификацией створок клапана, укорочением подклапанного хордального аппарата, ограничением экскурсии и задержкой закрытия створок. Кроме того, можно диагностировать и определить степень митральной регургитации. Для этого фиксируют количество и плотность контрастного вещества, попадающего в полость левого предсердия после сокращения левого желудочка (рис. 180-1). В этот же момент можно заметить систолический пролапс одной или обеих створок левого предсердно-желудочкового (митрального) клапана, вызванный либо нарушением функции хорд, либо первичной миксоматозной дегенерацией, а может быть, и увеличением самих створок. Данный метод позволяет выявить наличие даже небольшого подклапанного, клапанного или надклапанного устья стеноза аорты и такого характерного для гипертрофической кардиомиопатии признака, как неправильное сопоставление межжелудочковой перегородки и передней створки левого предсердно-желудочкового (митрального) клапана.
Как о регионарной, так и об общей функции левого желудочка можно судить на основании анализа тени полости левого желудочка на его вентрикулограмме. При этом можно выявить отсутствие сокращения в той или иной области миокарда (акинезия), определить степень угнетения сокращения (гипокинезия) или парадоксального систолического расширения (дискинезия), а также обнаружить явные признаки формирования аневризмы (рис. 180-2). Рядом с участками нарушенного колебания стенки желудочка видны пристеночные тромбы. Кроме того, увеличив изображение, можно довольно точно измерить площадь полости левого желудочка, а применив геометрическую эллипсоидную модель, — рассчитать объем этой камеры сердца в конце диастолы и систолы (см. рис. 180-1), а также общий ударный объем. Вычитая из общего ударного объема величину начального ударного объема (показатель, который рассчитывается независимым способом для определения сердечного выброса и о котором будет сказано ниже), можно затем определить долю аортальной или митральной регургитации за одно сокращение сердца.
Значения конечно-диастолического объема, превышающие 90 мл на 1 м2 поверхности тела, как правило, свидетельствуют о дилатации полости левого желудочка, вызванной сердечной недостаточностью или объемной перегрузкой, как, например, в случае аортальной или митральной регургитации. Фракция выброса, представляющая собой отношение величины ударного объема к величине конечно-диастолического объема, отражает процент укорочения миокарда левого желудочка. В нормальных условиях оно составляет 0,56—0,78. При уменьшении фракции выброса можно говорить об угнетении сократительной способности левого желудочка. Другим информативным показателем функции миокарда является средняя скорость укорочения циркулярных волокон, фракционное укорочение малой оси полости левого желудочка за единицу времени (см. рис. 180-1). Принято считать, что величины средней скорости укорочения циркулярных волокон менее 1,2 окружности в конце диастолы за 1 с в стабильном состоянии указывают на угнетение сократимости миокарда. (Другие признаки сниженной сократимости миокарда обсуждаются далее в разделе «Измерение внутрисосудистого и внутрисердечного давлений».)
Селективное контрастирование восходящего отдела аорты выполняют с целью определения тяжести аортальной недостаточности, размеров и локализации аневризмы аорты, для визуализации таких редко встречающихся врожденных пороков или приобретенных заболеваний, как синус аневризмы Вальсальвы, парааортальный синусоидальный тракт, инфекционный эндокардит, расслоение аорты вследствие кистозного медиального некроза. Для исследования функции левого предсердия или движения левого предсердно-желудочкового (митрального) клапана, а также для выявления внутриполостных тромбов или опухолей (миксома, рабдомиома, рабдомиосаркома) контрастное вещество вводят в полость левого предсердия.
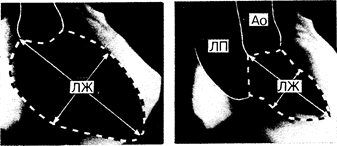
Рис. 180-1. Киноангиограмма с введением контрастного вещества в полость левого желудочка (ЛЖ).
Слева — конец диастолы, справа — конец систолы. Исследование выполнено в правой передней косой проекции у больного с тяжелой митральной регургитацией, у которого левое предсердие (ЛП) хорошо контрастируется одновременно с аортой (Ао) во время систолы желудочков. Объем (О) и размер ЛЖ определяют планиметрически, измеряя площадь камеры (ограничена пунктирной линией), длину большей оси (сплошная линия, соединяющая основание и верхушку) и используя геометрическую модель эллипсоида. Таким образом, Д = 4П/Л и O=(Д2Л/6), где Д—расчетный диаметр; Л—длина большей оси; П — площадь; О — объем ЛЖ. Средняя скорость кругового укорочения волокон также может быть рассчитана с помощью непосредственного измерения малой оси (показана стрелками), расположенной перпендикулярно к большей оси в ее середине. Зная скорость получения изображений и количество их, полученное от начала до завершения фазы изгнания, можно определить время изгнания.

Коронарная артериография. Наиболее часто выполняемой в лаборатории катетеризации полостей сердца диагностической процедурой является селективная ангиографическая визуализация коронарного артериального русла. Тщательное визуальное исследование атеросклеротических поражений коронарных артерий существенно углубило понимание патогенеза и естественного течения ишемической болезни сердца и в значительной мере способствовала становлению хирургии обструктивных поражений коронарных артерий. Кроме того, непосредственная визуализация анатомических особенностей коронарного русла позволяет выявить такие врожденные пороки, как аномальное отхождение коронарных артерий или коронарный артериовенозный свищ. Эргометрин, вводимый во время коронарной артериографии, индуцирует локальный спазм коронарного сосуда, что позволяет уточнить диагноз у больного, у которого в покое отмечаются загрудинные боли, похожие на вариантную стенокардию Принцметалла.
При выполнении коронарной артериографии по 5—10 мл контрастного вещества вводят непосредственно в устье каждой коронарной артерии. Одновременно с этим в множественных косых и угловых проекциях проводят киносъемку со скоростью 30—60 кадров в 1 с и/или 4—6 кадров в 1 с при замедленной съемке с широким форматом. Таким образом получают динамические изображения коронарного русла высокого разрешения (рис. 180-3). Специально разработанные катетеры, в одном случае это катетер с открытым, заостренным концом и несколькими боковыми отверстиями, вводят через плечевую артерию после ее выделения и вскрытия (метод Сона). В соответствии с другой методикой катетер чрескожно по леске-проводнику вводят в бедренную артерию. Предварительно катетеру придают определенную форму для того, чтобы его легче было направить к устью правой или левой коронарной артерии (метод Джадкинса). Оба метода обеспечивают визуализацию обструктивных поражений основных ветвей коронарных сосудов, что необходимо для постановки диагноза (рис. 180-4, а, б). Кроме того, при исследовании нередко можно обнаружить коллатеральные сосуды или вновь образованные сосудистые образования, снабжающие миокард в обход обструкции, а вследствие этого становятся видимыми и сосуды, расположенные ниже стенозированного участка (см. рис. 180-4, а). Очевидно, что последние данные очень важны при определении места имплантации дистального конца обходного сосудистого шунта.
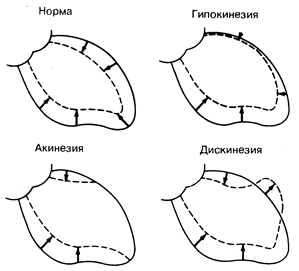
Рис. 180-2. Схематическое изображение конечно-диастолического (сплошная линия) и конечно-систолического (пунктирная линия) контуров левого желудочка на киноангиограммах при различных формах локального нарушения движения стенки желудочка у больных с коронарной болезнью сердца. У здорового человека сокращение сердца происходит относительно симметрично. У больного с гипокинезией подвижность миокарда в передней и верхушечной областях снижена; при дискинезии отмечается парадоксальное смещение передней поверхности желудочка в систолу кнаружи.
Цифровая ангиография. Цифровая компьютерная обработка флюороскопических или киноангиографических изображений, применяемая в настоящее время, обеспечивает высокое качество визуального восприятия структур как левых, так и правых отделов сердца. При многих исследованиях рентгеноконтрастное вещество вводится в периферическую или центральную вену, что позволяет избежать введения его непосредственно в левые отделы сердца. К настоящему времени выявлены следующие преимущества этого нового подхода к кардиоангиографии: 1) он сделал возможным определение размеров и геометрии полостей сердца с использованием меньших количеств контрастного вещества; 2) компьютерный расчет облегчил выведение количественных индексов, отражающих функцию левого желудочка; 3) регистрация ангиографических изображений обычно не провоцирует возникновение преждевременных сокращений сердца; 4) появилась возможность создавать и воспроизводить так называемые функциональные или параметрические изображения, позволяющие наглядно представлять физиологические или патофизиологические параметры, например регионарные колебания стенки желудочка (см. рис. 180-2), общее укорочение левого желудочка, скорость поступления и вымывания контрастного вещества из коронарных артерий или миокарда.
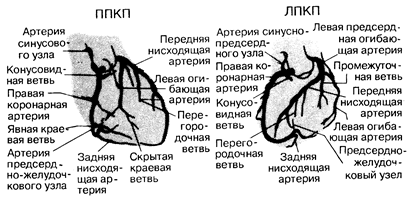
Рис. 180-3. Диаграмма коронарного артериального русла.
Построена по данным артериографии, проведенной в двух наиболее часто используемых проекциях— правой передней косой (ППК) и левой передней косой (ЛПК).
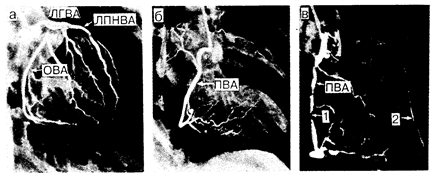
Рис. 180-4. Селективные коронарные артериограммы, полученные из правой передней косой проекции. а, б — артериограммы, полученные у здорового человека; в—у больного с тяжелым стенозом правой венечной артерии. Стрелка 1 указывает на участок сужения правой венечной артерии, а стрелка 2 — на ретроградное заполнение передней нисходящей венечной артерии через коллатеральные сосуды, что свидетельствует о тяжелой обструкции и этого сосуда. Обозначения: ЛГВА—левая главная венечная артерия; ОВА — огибающая венечная артерия; ЛПНВА — левая передняя нисходящая венечная артерия; ПВА — правая венечная артерия (Courtesy of M. P. Judkins).
Осложнения. Катетеризация правых отделов сердца редко сопровождается развитием осложнений или приводит к смерти больного. В то же время катетеризация и ангиография левых отделов сердца представляют собой процедуры, которые чреваты тяжелыми последствиями. Тем не менее диагностическая катетеризация полостей сердца в последние годы получает все большее распространение, что прежде всего обусловлено потребностью в точной информации о функциональном и анатомическом статусе коронарного русла у больного, которому предполагается хирургическое вмешательство на сердце. У детей особое внимание уделяется предотвращению развития во время обследования метаболических расстройств (гипоксии и ацидемии) и нарушений со стороны легких, а также техническим вопросам — использованию небольших количеств контрастных препаратов и гибких катетеров. Эти предосторожности существенно уменьшили частоту развития серьезных осложнений и привели к заметному снижению общей смертности у детей. В случае лечения взрослых больных выполнение аортокоронарного шунтирования поставило вопрос о преимущественном использовании ретроградной катетеризации аорты при выполнении коронарной артериографии и вентрикулографии левого желудочка по сравнению с другими доступами. По данным проспективного анализа осложнений коронарной артериографии, выполненного у 7553 больных, участвовавших в Кооперативном исследовании хирургии коронарных артерий (КИХКА) в 1979 г., общая смертность составила 0,2 %, частота развития инфаркта миокарда—0,025%, частота системных эмболий и повреждений сосудов — 0,09 и 0,74 % соответственно (данные первых 48 ч после выполнения процедуры). При выполнении коронарной артериографии с использованием плечевого доступа (метод Сона) риск смерти в 3,6 раза выше, чем при выполнении этой процедуры с использованием бедренного доступа, однако эти различия нивелируются, если метод Сона применяется персоналом лаборатории регулярно — более чем у 80 % больных.
Очевидно, что специальные инвазивные внутрисердечные манипуляции следует выполнять только в хорошо оборудованных лабораториях высококвалифицированным персоналом. Риск, связанный с выполнением катетеризации полостей сердца и ангиографии, необходимо тщательно взвешивать, сопоставляя с тем терапевтическим эффектом, который они позволят достичь после постановки точного анатомического и функционального диагноза.
Дата добавления: 2015-03-17; просмотров: 845;
