КОНТРОЛЬНА РОБОТА
Термодинаміка
Вага усіх речовин, що вступають до реакції, дорівнює вазі усіх продуктів реакції.
Закон постійності складу:кожна хімічна сполука має цілком визначений і постійний склад.
Еквівалентомназивається вагова кількість елементу, що з'єднується з однією (точніше –1,00797) ваговою частиною водню або такою, що замінює його у з'єднаннях. Важливість цього поняття для хімії визначається тим, що елементи завжди з'єднуються між собою у певних вагових співвідношеннях, що відповідають їх еквівалентам (закон паїв). Отже, склад складної речовини може бути виражений цілими числами еквівалентів тих елементів, що входять до неї.
Відношення маси даного об'єму одного газу до маси такого ж об'єму іншого називається щільністюпершого газу відносно іншого.
Таким чином, якщо прийняти масу атома водню за одиницю, то маса його молекули (MH) повинна дорівнювати двом, тоді формула для обчислення молекулярної ваги набуває вигляду:
M Н=2DH , (6.6)
тобто молекулярна вага речовини в газоподібному стані дорівнює його подвоєній щільності по відношенню до водню. Отже, для визначення молекулярної ваги досить знати масу деякого об'єму досліджуваної речовини в газоподібному стані і масу такого ж об'єму водню за тих же умов.
Грам-молекула любого газу займає за нормальних умов об'єм 22,4л.
Рівняння Клапейрона-Менделєєва:
PV= 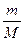 RT , (6.7)
RT , (6.7)
де P-тиск газу;
V-об'єм газу;
m-маса газу;
M-молекулярна вага газу;
R-газова постійна;
T- абсолютна температура (дорівнює 273+t за шкалою Цельсія).
Число, що показує, скільки еквівалентних важелів вміщується у атомній вазі, тобто результат поділу атомної ваги на еквівалентну, називається валентністюданого елементу.
Кількісне визначення реакції середовища можна ще більше спростити, якщо взяти за основу водневий показник (Ph), що визначається співвідношенням: Ph=-lgCh. Тоді нейтральне середовище характеризуватиметься Ph=7, кисла Ph=6;5;4 і т.п., лужна Ph=8; 9;10 і т.п. (рис.6.38). Зрозуміло, що можуть існувати і проміжні (між цілочисельними) значення водневого показника.
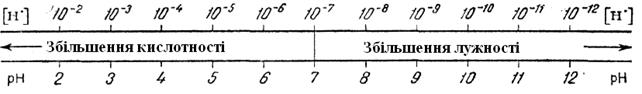
Малюнок 6.38- Схема позначення реакції середовища
Перший початок термодинаміки:
Q=ÑU+A, (6.8)
де Q – кількість теплоти, що передається системі;
ÑU - зміна внутрішньої енергії системи;
A - робота, що здійснюється системою.
Робота, що здійснюється газом при зміні об'єму від V1 до V2,
A= 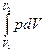 , (6.9)
, (6.9)
де p- тиск.
Для адіабатного процесу (Q=0):
ÑU= - A=NCV(T2-T1), (6.10)
Тут N- число молей ідеального газу, Cv-молярна теплоємність газу при постійному об'ємі, T2 і T1- початкова і кінцева температури.
Кількість теплоти для оберненого процесу:
Q=òTdS, (6.11)
Зміна ентропії при нагріванні або охолодженні речовини від температури T1 до температури T2:
ÑS=nCpln 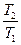 , (6.12)
, (6.12)
де Cp- молярна теплоємність при постійному тиску.
Швидкість зміни ентропії для стаціонарного стану у живому організмі
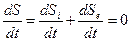 , (6.13)
, (6.13)
Тут dSi/dt – швидкість зміни ентропії, що пов'язана із не оберненими процесами у біологічній системі; dSe/dt –швидкість зміни ентропії внаслідок взаємодії системи з навколишнім середовищем.
Дата добавления: 2015-03-14; просмотров: 993;
