Фибриллярные структурные белки
Коллагены — основные гликопротеины соединительных тканей. Они составляют 25% всех белков организма человека и обеспечивают сопротивление растяжению в отличие от ПГ, которые противодействуют сжатию. В геноме человека 30 генов, кодирующих коллагеновые α-цепи. Выделено свыше 20 типов коллагеновых молекул (изоколлагены).
| Тип коллагена | Длина волокна | Состав | Выделен из |
| Тип I | 300 нм | [a(I)]2α2(I) | Кости, роговицы, дентина, клапанов сердца, стенки матки |
| Тип II | 300 нм | [a(II)]3 | Гиалинового хряща, стекловидного тела |
| Тип III | 300 нм | [a(III)]3 | Дермы, клапанов сердца, десны |
| Тип IV | 390 нм | [a(IV)]3 | Базальных мембран |
| Тип V | 300 нм | [a(V)]2α2(V) | Кости, роговицы, больших сосудов, клапанов сердца |
| Тип VI | 105 нм | a1(VI), a2(VI) | Кровеносных сосудов |
| Тип VII | 450 нм | a1(VII) | Эндотелия сосудов |
| Тип VIII | 150 нм | a1(VIII) | Эндотелия сосудов |
| Тип IX | 200 нм | a1(IX) α2(IX) | Хрящевой ткани |
| Тип X | 150 нм | a1(X) | Хрящевой ткани |
Изоколлагены типов I–III получили название фибрилформирующихколлагенов, а изоколлагены IX и XII — фибриллассоциируемыхколлагенов, так как они обычно связаны с коллагеновыми волокнами, которые образовали фибрилформирующие коллагены. Фибриллассоциируемые коллагены обеспечивают соединение волокон с другими молекулами матрикса. Типы IV и VII называют сетьформирующимиколлагенами. Они образуют сетевидные структуры и чаще всего находятся в базальных мембранах, обеспечивая связь клеточных слоев эпителия с подлежащей соединительной тканью. Это особенно важно для кожи.
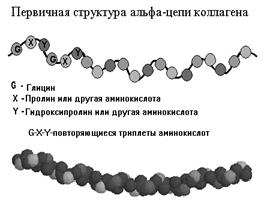
 Первичная структура коллагена — одиночная полипептидная цепь:
Первичная структура коллагена — одиночная полипептидная цепь:
1/3 – ГЛИ, 1/5 – ПРО и гидроксиПРО (ОН-ПРО), есть и ОН-ЛИЗ. К ней присоединен дисахарид (глюкоза + галактоза). Полипептидная цепь — левозакрученная спираль, но водородные связи отсутствуют, так как много иминокислот.
Вторичная структура — особый коллагеновый тип: 3 полипептидные цепи сворачиваются в тройную спираль. Эта спираль — правозакрученная.
Синтез коллагена.Полипептидные цепи синтезируются на полисомах в виде препроколлагена («пре»указывает на наличие сигнального, лидирующего пептида; «про»—наналичие дополнительных пептидов на N- и С-концах). Затем начинается процессинг препроколлагена.
| Порядок и локализация процессинга препроколлагена | |
| Внутриклеточно | Внеклеточно |
| 1. Удаление сигнального пептида 2. Гидроксилирование ПРО и ЛИЗ 3. Гликозилирование ОН-ЛИЗ 4. Образование внутри- и межцепочечных S-S связей в дополнительных пептидах 5. Образование тройной спирали | 1. Удаление дополнительных пептидов 2. Образование коллагеновых волокон с поперечной исчерченностью 3. Окислительное дезаминирование ε-аминогрупп ЛИЗ и ОН-ЛИЗ с образованием альдегидных групп 4. Образование поперечных связей в коллагеновых волокнах |
Разрушается коллаген коллагеназамиилизосомными ферментами — протеиназами игликозидазами.О «возрасте» коллагена можно судить по количеству поперечных ковалентных связей в коллагеновых волокнах: чем «моложе» коллаген, тем меньше поперечных связей, тем легче и быстрее он разрушается, и наоборот.
Эластин. Молекула эластина состоит из двух типов фрагментов, чередующихся вдоль цепи: гидрофобные (фибриллярные) сегменты, которые ответственны за эластические свойства молекулы и глобулярные сегменты, богатые АЛА и ЛИЗ, имеющие форму α-спирали и участвующие в формировании поперечных связей между молекулами эластина. В отличие от коллагена у эластина один генетический тип, мало ОН-ПРО, нет ОН-ЛИЗ, дополнительных пептидов, углеводов, не образуется тройная спираль. Синтезируется эластин в виде мономера, а внеклеточно происходит фибриллогенез с образованием поперечных связей с помощью аминокислоты десмозина — продукта межмолекулярной конденсации 4-х остатков ЛИЗ. Эластин — самый прочный из белков, известных в организме человека. Разрушается под действием фермента эластазы.
Дата добавления: 2015-03-11; просмотров: 1216;
