Работа 10. Потенциометрический метод определения рН растворов при помощи стеклянного электрода
Задача работы:изучение степени обратимости ионных реакций, определяющих потенциал мембранного стеклянного электрода, нахождение кислотности контрольного раствора.
Оборудование, материалы, реактивы:стеклянный электрод с Н+ - функцией, хлорсеребряный электрод сравнения, термометр на 50 ˚С, набор стандартных растворов для рН-метрии (или 0,05 М раствор HCl), раствор Вейбеля (или другой контрольный раствор с рНх), хромовая смесь, мерная посуда.
Выполнение работы:
1.  Подготавливают к работе стеклянный электрод. Для этого выдерживают его несколько минут в хромовой смеси, промывают дистиллированной водой и высушивают фильтровальной бумагой.
Подготавливают к работе стеклянный электрод. Для этого выдерживают его несколько минут в хромовой смеси, промывают дистиллированной водой и высушивают фильтровальной бумагой.
2. Составляют гальваническую цепь для измерения потенциала стеклянного электрода. В стаканчик емкостью 50 – 100 мл вводят стеклянный электрод и внешний хлоридсеребряный электрод сравнения. Выводы от электродов подключают к вольтметру (рН – метру, который работает в режиме измерения напряжения).
3.  Заполняют стакан раствором (20 – 30 мл) с известным значением рН (обычно это буферный раствор для рН – метрии). Измеряют температуру. Производят измерение потенциала стеклянного электрода (дожидаясь стационарного значения). По окончании измерения, отставляют стаканчик с измеряемым раствором и подставляют стаканчик с дистиллированной водой. Это делается для того, чтобы промыть электрод от предыдущего раствора, а также, чтобы стеклянный электрод не пересыхал. Сливают буферный раствор в ту посуду, где он хранится в лаборатории. Перед тем как подставить стаканчик с новым раствором, электрод высушивают фильтровальной бумагой, чтобы не произошло разбавления, а следовательно изменения концентрации ионов водорода. Проделывают то же самое с серией растворов с известными значениями кислотности. Пока меняют буферный раствор, стеклянный электрод постоянно должен находиться в дистиллированной воде. Результаты измерений заносят в таблицу 4.
Заполняют стакан раствором (20 – 30 мл) с известным значением рН (обычно это буферный раствор для рН – метрии). Измеряют температуру. Производят измерение потенциала стеклянного электрода (дожидаясь стационарного значения). По окончании измерения, отставляют стаканчик с измеряемым раствором и подставляют стаканчик с дистиллированной водой. Это делается для того, чтобы промыть электрод от предыдущего раствора, а также, чтобы стеклянный электрод не пересыхал. Сливают буферный раствор в ту посуду, где он хранится в лаборатории. Перед тем как подставить стаканчик с новым раствором, электрод высушивают фильтровальной бумагой, чтобы не произошло разбавления, а следовательно изменения концентрации ионов водорода. Проделывают то же самое с серией растворов с известными значениями кислотности. Пока меняют буферный раствор, стеклянный электрод постоянно должен находиться в дистиллированной воде. Результаты измерений заносят в таблицу 4.
Таблица 4
| рНа | |||||
| Ест, В |
При отсутствии стандартных растворов для рН – метрии готовят из 0,05 М (или 0,1М) раствора HCl последовательным разбавлением серию растворов с концентрацией 0,02; 0,01; 0,005; 0,002 и 0,001 М. Растворы готовят в мерных колбах на 100 или 50 мл. Расчет объема исходного раствора Vисх с концентрацией Сисх (0,05М или 0,1 М раствор HCl), который необходим для приготовления растворов с заданной концентрацией Снеоб (необходимой) ведут по формуле: 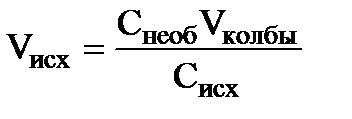 , где Vколбы – объем мерной колбы, в которой готовят раствор. Кислотность этих растворов рассчитывают по формуле: рНа = - lg (g±(HCl) · CHCl), где СHCl – молярная концентрация, а g±(HCl) – молярный средний коэффициент активности соляной кислоты, приведенный в таблице 5.
, где Vколбы – объем мерной колбы, в которой готовят раствор. Кислотность этих растворов рассчитывают по формуле: рНа = - lg (g±(HCl) · CHCl), где СHCl – молярная концентрация, а g±(HCl) – молярный средний коэффициент активности соляной кислоты, приведенный в таблице 5.
Таблица 5
| СНСl, М | 0,001 | 0,002 | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 |
| g±(НСl) | 0,965 | 0,953 | 0,926 | 0,904 | 0,874 | 0,830 | 0,695 |
Растворы соляной кислоты обратно в посуду не сливают.
4. Строят зависимость Ест от рНа. Проверяют ее линейность, находят наклон линейного участка dЕст / d(рНа) = ∆Ест / ∆ (рНа). Сопоставляют полученное значение с теоретическим, равным 2,3RT/F или 0,059 В при 298 К.
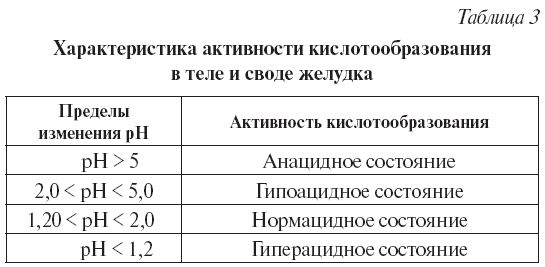
5. Заливают в стаканчик желудочный сок (или другой раствор с неизвестным рНх). Измеряют потенциал стеклянного электрода, определяют по графику кислотность данного раствора, сравнивают с нормой.
6. Анализируют результаты, формулируют выводы, оформляют работу.
Дата добавления: 2014-12-16; просмотров: 2347;
