Плотность растворов соляной кислоты
| Плотность, г/мл | Массовое содержание, % | Плотность, г/мл | Массовое содержание, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | 1,108 | ||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Если в таблице нет цифры, соответствующей найденной плотности, то последнюю вычисляют методом интерполяции по двум ближайшим величинам.
Например, плотность раствора HСl равна 1,032 г/мл.
Берут значения плотности больше и меньше измеренной, и соответствующие им концентрации. Находят разности:
1,028 – 6%
1,038 – 8%
0,01 – 2%
При увеличении плотности на 0,01 процентное содержание соляной кислоты увеличивается на 2%. Найденная плотность меньше наибольшего значения на 1,038 - 1,032 = 0,006. Находят процентное содержание, соответствующее плотности 0,006:
0,01 – 2%
0,006 - Х%
Х = (2 · 0,006) : 0,01 = 1,2 (%).
Вычитая эту величину из наибольшего значения, получают искомую величину:
8% - 1,2% = 6,8%.
5. Зная процентное содержание HCl, вычисляют объем концентрированного (исходного) раствора, который необходимо взять для приготовления 0,1N раствора HCl. Объем исходного раствора рассчитывают по формуле:
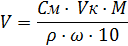
где
V – объем концентрированного (исходного) раствора HCl, мл;
См – молярная концентрация раствора (См = СN ·f), моль/л;
Vк – объем мерной колбы, мл;
М – молекулярная масса вещества, г/моль;
ρ - плотность исходного раствора, г/мл;
ω – процентная концентрация исходного раствора, %.
Например, необходимо приготовить 200 мл 0,1N раствора HCl, тогда
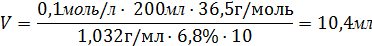
Следовательно, для приготовления 200мл 0,1N (См = 0,1N·1, т.к. f=1) раствора HCl нужно взять 10,4 мл соляной кислоты плотностью 1,032 г/мл.
5. Мерной пипеткой с точностью до десятых долей мл отмеривают рассчитанный исходный концентрированный раствор HCl, переносят в мерную колбу нужного объема и доводят до метки дистиллированной водой так, чтобы нижний край мениска касался метки.
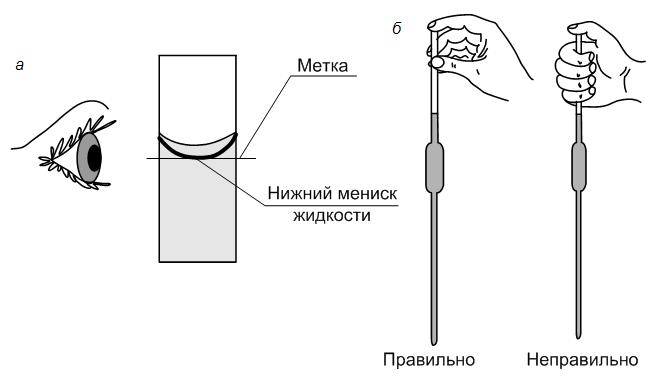

6. Закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз. Полученный таким образом раствор является приблизительно 0,1N. Точная нормальность такого раствора устанавливается с помощью титриметрических анализов.
7. Оформляют работу. Формулируют выводы.
Дата добавления: 2014-12-16; просмотров: 2825;
