Подбор пары реципиент - донор. Печень, как трансплантируемый орган, считается наиболее удобным с точки зрения тканевой совместимости.
Печень, как трансплантируемый орган, считается наиболее удобным с точки зрения тканевой совместимости.
Это объясняется известной иммунокомпетентностью печени, в некоторой степени подавляющей иммунный ответ организма реципиента.
Поэтому для подбора донорской печени конкретному реципиенту необходимым является лишь совпадение с донором по группе крови без учета совместимости по антигенам системы HLA.
В педиатрической практике особое значение приобретает подбор органа по антропометрическим параметрам, что становится более трудным по мере уменьшения массы тела реципиента.
В связи с крайним дефицитом трансплантатов малых размеров возникает необходимость использования различных модификаций печеночных трансплантатов (см. далее).
Хирургическая техника ортотопической трансплантации печени
Ортотопическая трансплантация печени представляет собой весьма обширное многоэтапное хирургическое вмешательство, которое справедливо считается наиболее сложным в абдоминальной хирургии.
Классическая методика ОТП с использованием печени трупного донора была разработана еще в 60-х годах T.Starzl и с тех пор не претерпела каких-либо принципиальных изменений.
Она заключается в том, что пораженная печень реципиента, включая позадипеченочный отдел нижней полой вены, полностью удаляется и замещается целым донорским органом.
Однако на протяжении уже более чем 30 лет методика ОТП подвергается различным модификациям для оптимизации решения конкретных технических задач, в частности, в области педиатрической трансплантации.
В 80-х годах именно дефицит донорских органов малых размеров обусловил почти 40 % летальность потенциальных реципиентов-детей, состоявших в листе ожидания ОТП в США и странах Европы.
Модификация операции, при которой большая донорская печень уменьшалась за счет удаления боковых сегментов для получения необходимого ребенку размера органа, резко уменьшила смертность детей в листе ожидания -с15%до5%.
Проблема дефицита донорских органов обусловила развитие метода разделения донорской печени при ОТП, когда один донорский орган используется для двух реципиентов.
Дальнейшие поиски решения проблемы дефицита донорских органов привели к использованию живых родственных доноров.
Главным преимуществом данного способа является возможность планирования времени трансплантации с соответствующей предоперационной подготовкой больного, также заведомо хорошее качество трансплантата.
Существенным практическим вкладом в развитие родственной трансплантации явилась оригинальная методика использования правой доли печени живого донора, разработанная в РНЦХ РАМН и имеющая мировой приоритет.
Хирургическая операция ОТП состоит из трех основных этапов.
1. Гепатэктомия (удаление собственной печени реципиента).
2. Имплантация донорской печени (реваскуляризация трансплантата).
3. Реконструкция желчеотведения.
Классическим хирургическим доступом для ОТП является комбинация билатерального субкостального разреза с вертикальным разрезом в проекции белой линии до мечевидного отростка в модификации R.Calne (рис. 1).
Гепатэктомия - наиболее травматичный этап ОТП.
Степень сложности гепатэктомии увеличивается с возрастом реципиента и длительностью существования болезни в связи с наступающими выраженными склеротическими изменениями тканей на фоне портальной гипертензии и хронического лимфостаза.
Длительное существование портальной гипертензии приводит к развитию множественных забрюшинных коллатералей, что затрудняет хирургические манипуляции при мобилизации печени.
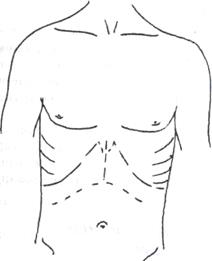
Рис. 1. Хирургический доступ для выполнения ортотопической
трансплантации печени (модификация R.Calne)
Для выполнения гепатэктомии сначала выделяют общую и собственно печеночные артерии и производят их препарирование от верхнего края 12-пер-стной кишки до бифуркации в воротах печени.
При этом целесообразно выделить место отхождения желудочно-двенадцатиперстной артерии, которое затем удобно использовать для формирования артерио-артериального анастомоза при реваскуляризации трансплантата.
Необходимо помнить о возможности наличия артериальной ветви от верхней брыжеечной артерии, которая обычно располагается позади гепатикохоледоха рядом с воротной веной.
Эта артерия может оказаться более удобной для реваскуляризации будущего трансплантата и поэтому она также пересекается ближе к воротам печени.
Гепатикохоледох выделяют из состава печеночно-двенадцатиперстной связки и пересекают его, а проксимальную культю его лигируют.
Мобилизация гепатикохоледоха не предусматривает его скелетизации, так как чрезмерная скелетизация гепатикохоледоха может привести к нарушению кровоснабжения его стенки.
Уровень пересечения протока зависит от планируемого вида билиарной реконструкции.
Пересечение гепатикохоледоха и его мобилизация создают благоприятные условия для дальнейшего препарирования печеночно-двенадцатиперстной связки, в частности, ствола воротной вены.
Результатом манипуляций на печеночно-двенадцатиперстной связки является скелетирование как печеночной артерии на всем протяжении от 12-перстной кишки до ворот печени, так и воротной вены, пересечение гепатикохоледоха и полное удаление клетчатки и лимфатических узлов.
После рассечения круглой, серповидной, правой и левой треугольных связок печени выделяют переднюю поверхность поддиафрагмального отдела нижней полой вены.
Рассечением париетальной брюшины по нижней поверхности правой доли печени начинается ретропеченочная мобилизация органа, при которой обнажается позадипеченочный отдел нижней полой вены, который выделяют со всех сторон книзу до устий почечных вен.
При этом выполняется выделение, перевязка и пересечение вены (или вен) правого надпочечника.
При гепатэктомии с сохранением нижней полой вены (см. далее) мобилизация последней также целесообразна для профилактики кровотечения из мелких ветвей в ее просвет.
После полной мобилизации печени приступают к ее удалению.
Долевые печеночные артерии перевязывают и пересекают, затем наложением сосудистого зажима прекращают кровоток по воротной вене, дистальный участок воротной вены перевязывают в воротах печени и пересекают.
Нижнюю полую вену пережимают ниже и выше печени.
Печень удаляют либо вместе с участком нижней полой вены, либо с сохранением последней.
Сохранение позади-печеночного отдела нижней полой вены при гепатэктомии необходимо в тех случаях, когда в качестве трансплантата используется левая доля или левый латеральный сектор трупной печени, а также фрагмент печени от живого родственного донора (см. далее).
Уже в конце первого этапа начинается так называемый беспеченочный период.
Этот период подразумевает выключение печени из кровообращения и прекращение кровотока по нижней полой вене.
Он продолжается до момента реперфузии трансплантата портальной кровью в процессе имплантации.
Общепринятой методикой для стабилизации состояния реципиента в беспеченочном периоде является проведение порто-бедренно-аксиллярного шунтирования, при котором забираемая отдельно из портального бассейна (2) и отдельно из бассейна нижней полой вены (1-3) кровь с помощью специального центрифужного насоса (5) принудительно вливается в систему верхней полой вены (4) через левую аксиллярную вену (рис.2).
Однако проведение вено-венозного шунтирования у реципиентов с массой тела менее 20 кг весьма затруднено и в настоящее время не используется.
С учетом накопления хирургического и анестезиологического опыта при ОТП, а также в связи с организационными, техническими и финансовыми проблемами, присущими использованию вено-венозного шунтирования, в ряде трансплантационных центров наблюдается тенденция к постепенному отказу от его проведения не только у детей, но и у взрослых.
Завершающим этапом гепатэктомии, выполняемой по любой методике, является контроль гемостаза и подготовка поддиафрагмальной культи нижней полой вены реципиента для анастомоза с нижней полой веной трансплантата, либо подготовка сохраненной нижней полой вены реципиента, заключающаяся в ушивании мелких отверстий в ее стенке после удаления печени.
Имплантация донорской печени
Результат ортотопической трансплантации печени, в значительной степени, зависит от того, насколько хирургу удастся воссоздать естественные условия, приемлемые для функционирования трансплантата в организме реципиента.
В связи с этим методика имплантации варьирует в зависимости от разновидности используемого трансплантата.
Такими разновидностями являются:
1) трупная печень (целая);
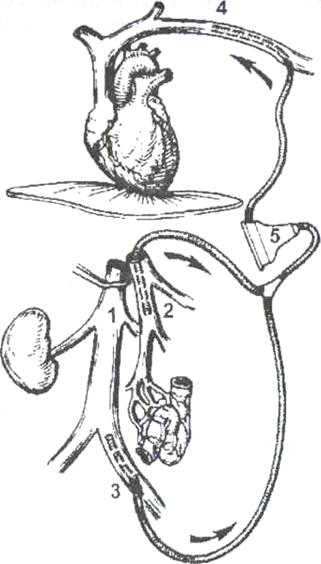
Рис. 2. Схема порто-бедренно-аксиллярного шунтирования в беспеченочном периоде. 1) нижняя полая вена, 2) канюля в воротной вене, 3) канюля в левой подвздошной вене, 4) канюля в левой подмышечной вене, 5) центрифужный насос
2) «уменьшенная» трупная печень;
3) анатомические доли или левый латеральный сектор трупной печени после разделения одного трансплантата для двух реципиентов;
4) анатомические доли или левый латеральный сектор печени живого родственного донора.
Методика имплантации целой трупной печени является основой для всех других модификаций.
Трансплантат ортотопически располагают в брюшной полости.
Первым накладывается верхний (поддиафрагмальный) анастомоз между культей нижней полой вены реципиента и донорским фрагментом того же сосуда.
Он представляет наибольшие трудности в связи с ограничением возможности манипулирования и обзора в этой области.
Затем накладывается нижний (подпеченочный) кава-кавальный анастомоз.
При этом восстанавливается непрерывность нижней полой вены.
В случае использования вено-венозного шунтирования канюлю из воротной вены реципиента извлекают, и воротную вену пережимают сосудистым зажимом.
Анастомоз между воротной веной реципиента и воротной веной трансплантата накладывается конец-в-конец с учетом возможного несовпадения диаметров этих сосудов, что корригируется различными вариантами сосудистого шва.
Наложение трех описанных анастомозов обеспечивает возможность возобновления портального и кавального кровотоков.
Анестезиологическая бригада должна быть заранее информирована о пуске портального кровотока через трансплантат, чтобы своевременно корригировать гемодинамические изменения и нарушения гомеостаза.
Реперфузии трансплантата должно предшествовать внутривенное введение метил-преднизолона из расчета 20 мг/ кг массы тела реципиента (но не более 1000 мг).
Для реперфузии трансплантата первым снимают зажим с надпеченочного участка нижней полой вены, а затем с воротной вены.
Последним снимается зажим с подпеченочного отдела нижней полой вены, что восстанавливает кавальный кровоток (рис.3).
Методика венозной реконструкции при имплантации «уменьшенной» печени, равно как и правой доли от разделенной печени трупа и последовательность действий идентичны описанным выше.
Разновидностью методики кавальной реконструкции при использовании этих трех видов трансплантатов является наложение единственного кава-кавального анастомоза.
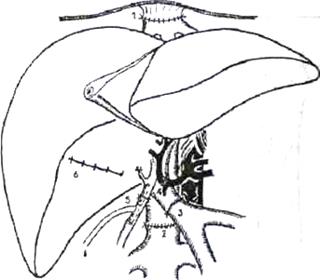
Рис. 3. Окончательный вид имплантированной трупной печени. 1) верхний (поддиафрагмальный) кава-кавальный анастомоз, 2) нижний (подпеченочный) кава-кавальный анастомоз, 3) порто-портальный анастомоз, 4) артериальная реконструкция с использованием общей печеночной артерии реципиента, 5) билиарная реконструкция - холедохо-холедохоанастомоз на Т-образном дренаже, 6) ушитое ложе желчного пузыря
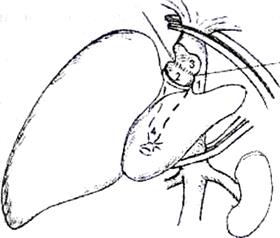
Рис.4. Вариант имплантации трупной печени при сохранении нижней полой
вены реципиента. 1)сохраненный позадипеченочный отдел нижней полой вены реципиента, 2) надпеченочное отверстие нижней полой вены трансплантата, 3) отверстие в передней стенке нижней полой вены реципиента после иссечения устий печеночных вен, 4) дистальный отдел нижней полой вены трансплантата
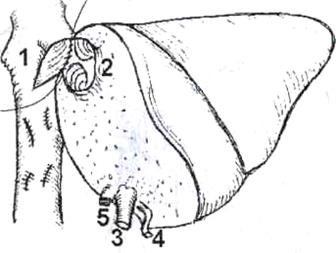
Рис.5. Печеночно-кавальная реконструкция при имплантации левой доли печени.
1) нижняя полая вена реципиента после гепатэктомии: отверстие в переднелевой боковой стенке анастомозируется с устьем общего ствола левой и срединной
печеночных вен трансплантата, 2) устье общего ствола левой и срединной печеночных вен трансплантата, 3) воротная вена трансплантата, 4) артерия трансплантата, 5) желчный проток трансплантата
Это бывает возможно в случаях, когда гепатэктомия у реципиента выполняется с сохранением позадипеченочного фрагмента нижней полой вены.
Для осуществления методики надпеченочное отверстие нижней полой вены трансплантата анастомозируется с отверстием в передней стенке нижней полой вены реципиента, образованным при иссечении устий печеночных вен.
При этом дистальный отдел нижней полой вены трансплантата просто перевязывается (рис.4).
Венозная реконструкция при использовании в качестве трансплантата левой доли или левого латерального сектора трупной печени, а также анатомических долей и левого латерального сектора печени живого родственного донора имеет ряд особенностей.
Во всех указанных случаях при гепатэктомии у реципиента необходимо сохранить позадипеченочный отдел его нижней полой вены.
В отличие от предыдущих видов донорской печени, трансплантаты данной группы не имеют собственного донорского участка нижней полой вены.
Поэтому восстановление венозного оттока выполняется путем соединения печеночной вены трансплантата с нижней полой веной реципиента в виде печеночно-кавального анастомоза конец-в-бок или в виде печеночно-печеночного анастомоза конец-в-конец с культей одноименной печеночной вены реципиента.
Основной задачей при этом является профилактика нарушения венозного оттока при возможных смещениях трансплантата в брюшной полости.
В связи с этим предпочтительным является печеночно-кавальная реконструкция конец-в-бок (рис.5).
В этой связи заслуживает внимания методика имплантации правой доли печени от живого родственного донора, разработанная и применяемая в РНЦХ РАМН с 1997 года.
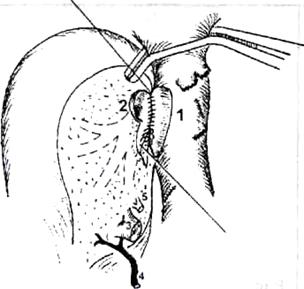
Рис.6. Печеночно-кавальная реконструкция при имплантации правой доли печени от живого родственного донора по методике РНЦХ РАМН.
1) нижняя полая вена реципиента после гепатэктомии: искусственно сформированное отверстие в стенке нижней полой вены после иссечения устья правой печеночной вены, 2) устье печеночной вены трансплантата увеличено за счет рассечения боковой стенки сосуда в дистальном направлении, 3) воротная вена трансплантата, 4) артерия трансплантата, 5) желчный проток трансплантата
Суть методики - в создании как можно более широкого печеночно-кавального анастомоза, что достигается искусственным расширением устий правых печеночных вен трансплантата и реципиента (рис.6).
Особенностью портальной реконструкции при использовании указанных трансплантатов является то, что порто-портальный анастомоз накладывают между стволом воротной вены реципиента и воротной веной трансплантата, которая является долевой (правой или левой) ветвью воротной вены донора.
Возможности артериальной реконструкции, то есть воссоздания артериального притока к трансплантату также зависят от вида используемого трансплантата.
Так, все виды трупных трансплантатов, кроме левой доли и левого латерального сектора, при соблюдении правил изъятия донорской печени располагают неограниченной длиной артериального сосуда вплоть до фрагмента аорты.
В то же время родственные трансплантаты и левые фрагменты трупной печени, как правило, имеют только долевую артерию, длина которой не превышает 3-4 см.
Артериальная реконструкция, чаще всего, выполняется путем анастомозирования общей или собственно печеночной артерий трансплантата конец-в-конец с общей печеночной артерией реципиента в месте отхождения желудочно-двенадцатиперстной артерии.
Существует множество других, более сложных, вариантов в зависимости от анатомических особенностей (рис.7).
Артериальную реваскуляризацию трансплантатов у совсем маленьких детей можно выполнять непосредственно от аорты, используя либо трупный донорский сосуд, включающий участок аорты, либо артериальную или венозную донорскую вставку.
Анастомоз с аортой реципиента в таких случаях накладывается либо выше отхождения чревного ствола, либо ниже почечных артерий.
Однако за последние 10 лет методика артериальной реваскуляризации трансплантатов у маленьких детей возвращается к традиционному способу анастомозирования печеночных артерий донора и реципиента с помощью микрохирургической техники.
Выбор способа билиарной реконструкции зависит от конкретных обстоятельств, складывающихся в результате имплантации донорской печени, в частности, от характеристик желчного протока (или протоков) конкретного трансплантата и реципиента.
Наиболее физиологичным считается восстановление непрерывности гепатикохоледоха путем анастомозирования донорского и собственного фрагментов протока конец-в-конец (см. рис.3).
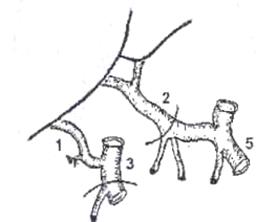
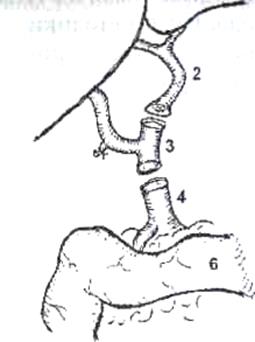
Рис.7. Вариант артериальной реконструкции при имплантации трупной печени. Слева - анатомический вариант артериального кровоснабжения печени донора.
Справа - артериальная реконструкция в организме реципиента. 1) правая печеночная артерия трансплантата (ветвь верхней брыжеечной артерии),
2) собственно печеночная артерия трансплантата (из системы чревного ствола),
3) верхняя брыжеечная артерия, 4) собственно печеночная артерия реципиента,
5) чревный ствол и его ветви, 6) двенадцатиперстная кишка реципиента
Такой билиобилиарный анастомоз принято формировать на каркасном Т-образном дренаже, который одновременно служит для декомпрессии.
Причинами отказа от такой реконструкции могут явиться несовпадение диаметров протоков, чрезмерное натяжение, а также сомнения в адекватности кровоснабжения стенок протоков как у донора, так и у реципиента.
Кроме того, при исходном заболевании печени, связанном с болезнью протоков, например при первичном склерозирующем холангите, показания к использованию дистальной культи холедоха реципиента весьма противоречивы.
Таким образом, при наличии сомнений в адекватности желчных протоков донора и/или реципиента для наложения билиобилиарного соустья методом выбора становится билиодигестивный анастомоз, то есть холедохо(гепатико)-еюностомия с петлей кишки, выключенной по Roux.
Реконструкция желчеотведения при использовании родственных трансплантатов или левосторонних фрагментов трупной печени связана с дополнительными трудностями, так как эти трансплантаты, как правило, не имеют каких-либо значимых по длине отрезков желчных протоков вне паренхимы трансплантата.
Устья таких протоков зияют на поверхности среза паренхимы (рис.8).
Их число варьирует от 1 до 4.
Это требует наложения соответствующего числа билиодигестивных анастомозов, что предусматривает использование весьма прецизионной хирургической техники при оптическом увеличении (рис.9).
Посттрансплантационный период
Под посттрансплантационным периодом следует понимать жизнь реципиента с функционирующим трансплантированным органом (в данном случае - донорская печень) независимо от ее продолжительности.

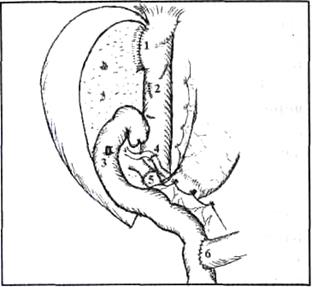
Рис.8. Имплантация правой доли печени живого родственного донора (интраоперационная фотография).
Сосудистая реконструкция закончена.
1) порто-портальный анастомоз, 2) артерио-артериальный анастомоз, 3) зияющее устье печеночного протока трансплантата перед наложением билиодигестивного анастомоза
Рис.9. Имплантация правой доли печени живого родственного донора закончена (схема):
1) печеночно-кавальный анастомоз, 2) ушитые дефекты в стенке нижней полой вены после
гепатэктомии, 3) проекция гепатикоеюноанастомоза, расположенного на задней стенке кишки, 4) артерио-артериальный анастомоз, 5) порто-портальный анастомоз, 6) межкишечный анастомоз (по Roux)
Нормальное течение этого периода у взрослого реципиента подразумевает выздоровление от болезни печени и ее осложнений, физическую и социальную реабилитацию, а у детей посттрансплантационный период должен гарантировать ряд дополнительных условий, таких как физический рост, интеллектуальное развитие и половое созревание.
Дата добавления: 2014-12-14; просмотров: 928;
