Основные показатели качества воды
Примеси поступают в воду, находящуюся в природном круговороте, из окружающей ее среды. Вода, занимающая около 70 % поверхности Земли, испаряясь, поступает в атмосферу, а после конденсации водяных паров в верхних слоях атмосферы возвращается на поверхность Земли в виде осадков, образуя поверхностные и подземные стоки и водоемы. Подземные стоки создаются при просачивании атмосферной воды в более или менее глубокие слои почвы, где вода собирается над водонепроницаемыми пластами, стекает по ним и выходит вновь на поверхность земли в местах выхода этих пластов, сливаясь с поверхностными стоками.
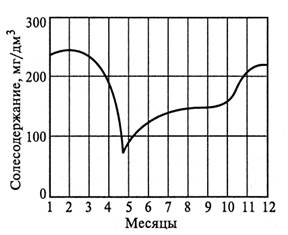 Количественный и качественный составы примесей рек и водоемов зависят от метеорологических условий и подвержены сезонным колебаниям. Так, в весенний паводковый период, после вскрытия льда, воды содержат минимальное количество растворенных солей, однако характеризуются максимальным количеством взвешенных веществ, увлекаемых с поверхности почвы быстрыми потоками талых вод. В зимний период в результате питания поверхностного водотока подземными водами его солесодержание достигает максимума (рис. 1.1).
Количественный и качественный составы примесей рек и водоемов зависят от метеорологических условий и подвержены сезонным колебаниям. Так, в весенний паводковый период, после вскрытия льда, воды содержат минимальное количество растворенных солей, однако характеризуются максимальным количеством взвешенных веществ, увлекаемых с поверхности почвы быстрыми потоками талых вод. В зимний период в результате питания поверхностного водотока подземными водами его солесодержание достигает максимума (рис. 1.1).
Рисунок 1.1 - Изменение солесодержания по временам года.
В летнее время состав речной воды определяется соотношением в питании долей поверхностного и подземного стоков.
Географические и сезонные изменения состава природных вод необходимо учитывать при использовании показателей качества природной воды для того, чтобы не определять пригодность водотока по результатам единичного наблюдения, выполненного на значительном расстоянии от планируемого места водозабора.
Для оценки качества природных вод и вод энергообъектов на различных стадиях технологического процесса приняты нижеперечисленные показатели. Все показатели определяются в профильтрованных пробах воды за исключением одного показателя содержания взвешенных веществ, который определяется непосредственно в отобранной пробе с помощью весового метода. Исследуемую воду фильтруют через предварительно высушенный и взвешенный бесзольный бумажный фильтр. По окончанию фильтрования фильтр с задержанными грубодисперсными частицами высушивают при t = 105 ºС до постоянной массы, затем опять взвешивают и прирост массы выражают в мг/л.
В связи с тем, что определение масс достаточно трудоемко при необходимости быстрого получения результата анализа пользуются косвенным методом. Определяют прозрачность воды по ''кресту'' или по ''шрифту''.
Сухой остаток (мг/л) определяется путем выпаривания определенного объема предварительно профильтрованной пробы и последующего просушивания остатка при температуре 110-120 ºС. Сухой остаток выражает содержание растворенных в воде минеральных и органических примесей нелетучих при указанной температуре. Содержащиеся в природной воде гидрокарбонаты Сa и Mg - Сa(HCO3)2 и Mg(HCO3)2 при указанной температуре разлагаются с выделением H2O и CO2 и в сухом остатке появляется CaCO3 и MgCO3, что следует иметь ввиду, сравнивая сухой остаток с минеральным.
Минеральный остаток (общее солесодержание) подсчитывается путем суммирования концентраций катионов и анионов, определенных при проведении полного химического анализа воды.
Прокаленный остаток характеризует содержание в воде минеральных веществ. Он определяется путем прокаливания при 800 ºС сухого остатка. При прокаливании сгорают органические вещества, частично разлагаются карбонаты.
Окисляемость – показатель, характеризующий содержание в воде органических веществ. В связи с трудностью аналитического определения индивидуальных органических веществ оценивается их суммарное содержание по количеству окислителя, расходуемого на их окисление. Обычно в качестве окислителя используется перманганат калия (KMnO4) и определяют ''перманганатную окисляемость'', выражаемую в условном пересчете на кислород (мг/л О2).
Общая жесткость, представляющая собой суммарную концентрацию в воде ионов Ca2+ и Mg2+ (катионы). Жесткость выражается или в мг экв/л воды или в мкг экв/л. Общая жесткость подразделяется на карбонатную и некарбонатную.
- Карбонатная жесткость обусловливается наличием в воде бикарбонатов и карбонатов Са и Mg [Mg(HCO3)2 и Сa(HCO3)2, CaCO3, MgCO3]. Эту жесткость называют временной.
- Некарбонатная жесткость (постоянная) характеризуется присутствием в воде сульфатов и хлоридов Са и Mg [CaCl2, CaSO4, MgCl2, MgSO4].
ЖО = ЖК + ЖНК
При кипячении гидрокарбонаты разрушаются, образующиеся при этом малорастворимые карбонаты выпадают в осадок, и общая жесткость воды уменьшается на величину карбонатной или временной жесткости. Хлориды и сульфаты при кипячении не разрушаются, поэтому некарбонатная жесткость постоянна.
Общая щелочность воды (ЩО) – суммарная концентрация в воде растворимых гидроксидов и анионов слабых кислот [HCO3-, CO32-] за вычетом концентрации ионов водорода. Общая щелочность выражается в мг экв/л и определяется титрованием пробы воды кислотой в присутствии индикаторов (фенолфталеин и метилоранж). Для вод, в которых может содержаться гидратная форма щелочности [ОН-], карбонатная [СО32-] и бикарбонатная [НСО3-] вычисление отдельных форм общей щелочности определяется по специальным таблицам.
Таблица 1.1 – Цвета индикаторов в различных растворах
| Вид индикатора | Кислая среда | Нейтральная | Щелочная |
| Фенолфталеин | рН < 8 (бесцветный) | 8<рН<9,8 (бледно- малиновый) | рН>9,8 (малиновый) |
| Метилоранж | рН<3,1(красный) | 3,1<рН<4,4 (оранжев) | рН>4,4 (желтый) |
Природные воды в своем большинстве характеризуются бикарбонатной формой щелочности, которая близка по величине к общей щелочности ЩБ ≈ ЩО. В природных исходных водах соотношение между щелочностью и общей жесткостью могут быть различными. Соответственно вычисляются значения карбонатной жесткости.
Дата добавления: 2014-12-13; просмотров: 1787;
