Будова атома
Моими главными консультантами по истории являлись Сэм Кон, Джефри Хиндли и Мерилин Ливингстон. Дефекты в фундаменте Кингсбриджского собора напоминают историю, произошедшую в соборе Санта-Мария в Витории (Испания), и я благодарен за помощь сотрудникам фонда собора Санта-Мария, особенно Карлосу Родригесу де Диего, Гонсало Арройте и переводчику Луису Риверо. Мне также помогали служащие собора Йорка, прежде всего Джон Дэвид. Мартин Аллен из кембриджского музея Фитцуильям (Англия) любезно позволил мне своими руками потрогать монеты эпохи правления Эдуарда III. В Ле-Мон-сен-Мишель (Франция) мне помогали сестра Юдит и брат Франсуа. Как всегда, нужные сведения мне помогал находить Дэн Старер из нью-йоркского агентства «Поиск для писателей». Моими литературными консультантами стали Эми Берковер, Лесли Гелбмен, Филлис Гранн, Нейл Нирен, Имоген Тейлор и Эл Цукерман. Комментариями и критическими замечаниями мне также помогали друзья и родные, особенно Барбара Фоллетт, Эмануэль Фоллетт, Мари-Клэр Фоллетт, Эрика Джонг, Тони Макуолтер, Крис Мэннерс, Джэн Тернер и Ким Тернер.
[1] Средник — срединный вертикальный брусок оконной рамы. — Здесь и далее примеч. ред.
[2] Трансепт — поперечный неф.
[3] Каннелюр — вертикальный желобок на стволе колонны.
[4] Травеи — в романской и готической архитектуре пространственная ячейка нефа, ограниченная четырьмя устоями, несущими свод.
[5] Нервюра — выступающее ребро готического крестового свода.
[6] Сквайр (зд.): сопровождающий.
[7] Вилланы — категория феодально-зависимого крестьянства.
[8] Шлюха (лат.).
[9] Галл — чернильный орешек (нарост на листьях дуба).
[10] Гунтер — верховая лошадь, тренированная для охоты.
[11] Вердерер — должностные лица, следившие за соблюдением законов о лесах, принадлежащих короне.
[12] В готическом архитектуре в части горгульи открывался водосток.
[13] Фьеф — феодальное поместье.
[14] Шелыга — линия, соединяющая верхние точки дуги.
[15] Фидель — гитарообразный смычковый инструмент, один из предшественников скрипки.
[16] Коб — порода коренастых верховых лошадей.
[17] Щетка — волосы за копытом лошади.
[18] Ордонанс — королевский указ (в отличие от статута — закона, утвержденного королем по предложению парламента).
[19] Украшенные миниатюрами.
[20] Образ действий (лат.).
Будова атома
Атоми металічних та неметалічних елементів відрізняються між собою будовою, а тому і властивостями. З чого складається атом? Атом складається з електронів та ядра, що містить у собі протони і нейтрони. Схематично модель будови атома можна представити так:
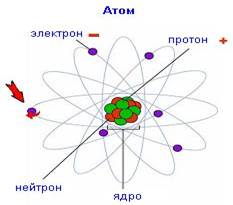
Рис.1.1 Модель будови атома
Нейтрони заряду не мають, протони – заряджені позитивно, тому загальний заряд ядра атома завжди додатній «+». Електрони – це від’ємно заряджені частинки «-», що рухаються навколо ядра. Кількість протонів та електронів в атомі рівна, тому атом в цілому – електронейтральний.
Атоми одного і того самого хімічного елемента – однакові, атоми різних хімічних елементів різні між собою. Номер хімічного елемента у періодичній таблиці, співпадає з кількістю електронів та протонів в атомі. Наприклад порядковий номер Алюмінію (Al) – 13, це означає, що атом цього елемента містить 13 електронів та 13 протонів, заряд ядра +13.
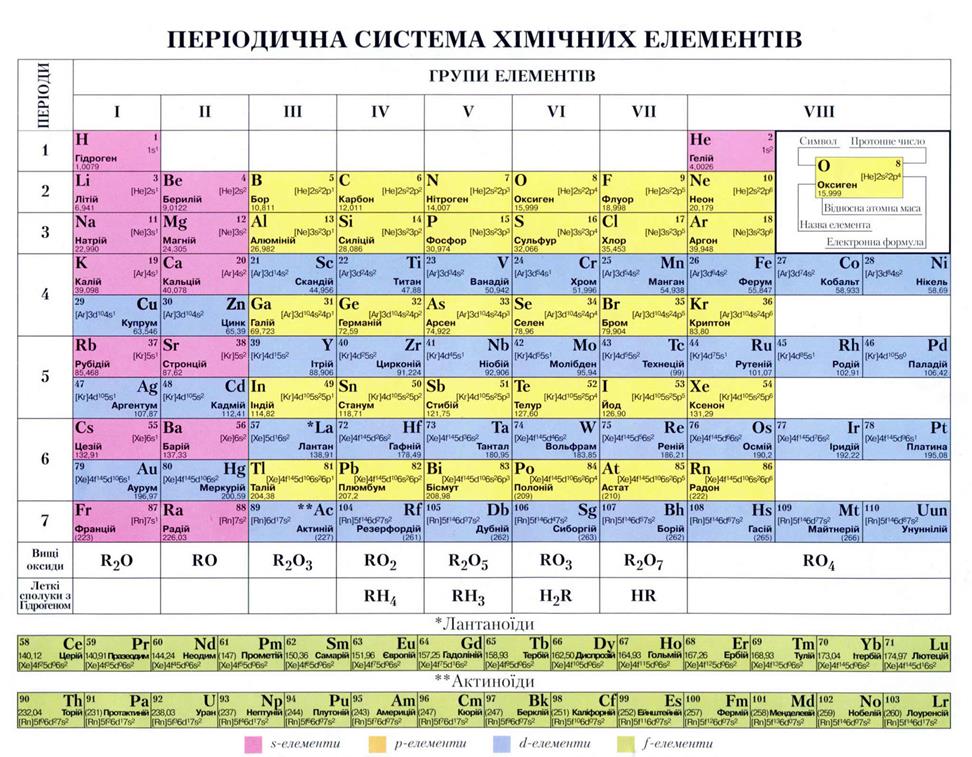
Взаємозв’язок будови атома та його місця розташування в періодичній таблиці
У періодичній таблиці елементи розташовуються в порядку зростання заряду ядра, займаючи кожний своє положення в періодах та групах. Період– це горизонтальний ряд хімічних елементів, розташованих в порядку зростання заряду ядра, в межах кожного періоду спостерігається поступова зміна хімічних властивостей елементів від металічних до неметалічних. Група- вертикальний стовпчик періодичної таблиці, у якому елементи з однаковою валентністю та подібними хімічними властивостями розташовані один під одними.
Всього вирізняють 7 періодів та 8 груп. Номер періоду вказує на кількість енергетичних рівнів (оболонок) в атомі, а номер групи вказує на валентність, тобто кількість електронів зовнішнього енергетичного рівня, що можуть утворювати хімічний зв'язок з іншими атомами.
|

|
|

|
|
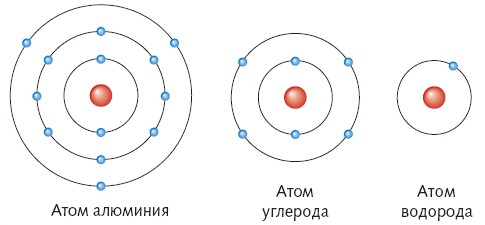
Рис.1.2 Приклад будови атомів
Якщо уважно розглянути будову періодичної таблиці, можна побачити, що основна кількість металічних елементів розташовується у І, ІІ та ІІІ, рідше ІV групі, це означає те, що метали мають 1, 2 або 3 валентні електрони. Неметалічні елементи мають від 3 до 7 електронів зовнішнього енергетичного рівня. Тому під час утворення сполук (виникнення хімічного зв’язку між атомами) метали, як правило будуть віддавати свої валентні електрони, а неметали, забиратимуть їх. Віддаючи або приймаючи електрон, атом втрачає свою нейтральність, перетворюється на «+» або «-» заряджену частинку: катіон або аніон.
Періодичний закон встановлює взаємозалежність між будовою атомів та їхніми хімічними властивостями.
Періодичний закон Д.І. Менделєєва: властивості елементів, а відповідно і властивості утворених ними простих і складних* речовин перебувають у періодичній залежності від величини заряду ядра їх атома.
Прості речовини – це такі речовини, які складаються з атомів одного і того самого хімічного елементу (Н2,О2,Сl2).
Складні речовини – це такі речовини, які складаються з атомів різних хімічних елементів (H2O, H2SO4, NaCl, C2H5OH).
1.2 Основні класи неорганічних сполук
Усі неорганічні сполуки, які існують в природі, поділяють на чотири класи: кислоти, основи, оксиди, солі. Вони відрізняються між собою за властивостями та складом.
Табл.1.1 Основні клас неорганічних сполук
| Оксиди | Основи | Кислоти | Солі |
| це неорганічні сполуки, які складаються з двох хімічних елементів, одним із яких є Оксиген | це неорганічні сполуки, які складаються з металу та гідроксильної групи ОН | це неорганічні сполуки, які складаються з Гідрогену та кислотного залишку | це неорганічні сполуки, які складаються з металу та кислотного залишку |
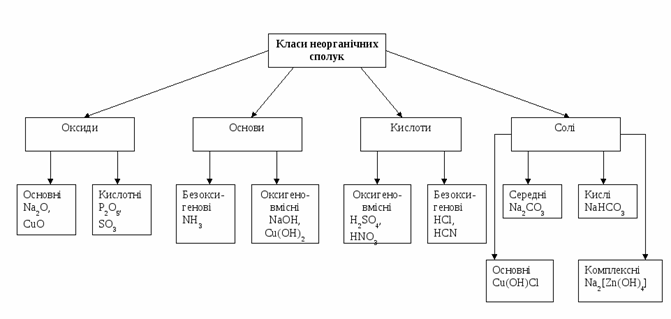
Рис.1.3 Класифікація неорганічних сполук
Табл.1.2 Таблиця кислот 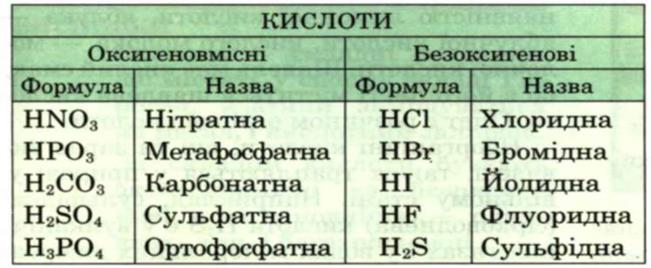
Розділ 2. Метали і сплави
2.1 Загальна характеристика металів. Фізичні властвості металів
Металічні елементи займають в основному ліву нижню частину Періодичної системи хімічних елементів Д. І. Менделєєва. До металічних елементів належать ті елементи, в чиїх атомах на зовнішньому електронному рівні перебуває невелике (від одного до чотирьох) число електронів, які атоми можуть легко віддавати.
Метали мають низку Загальних фізичних властивостей:
— електропровідність;
— теплопровідність;
— металічний блиск;
— пластичність (ковкість);
— зазвичай високу твердість;
— найчастіше перебувають у твердому агрегатному стані.
Про приналежність речовини до металів не можна судити тільки за однією ознакою. Так, деякі неметали можуть проводити електричний струм (графіт), мають металічний блиск (йод), мають пластичність (пластична сірка). Таким чином, відносити ту чи іншу просту речовину до металів або неметалів можна тільки за сукупністю ознак.
Загальні фізичні властивості металів (електропровідність, теплопровідність, блиск тощо) пояснюються наявністю рухливих електронів, інакше кажучи, особливим характером металічного зв’язку.
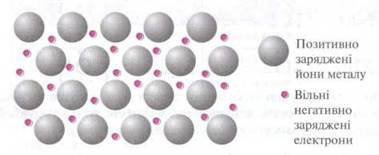
Рис.2.1 Схематичне зображення будови кристалічної решітки металів
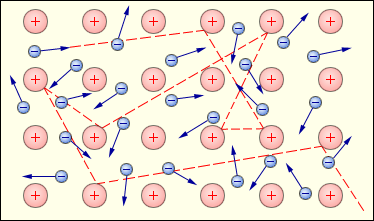
Рис. 2.2 Схематичне зображення хаотичного руху вільних електронів («електронного газу») між вузлами кристалічної решітки
Однак різні метали все-таки мають різні фізичні властивості, такі, як температура плавлення, густина тощо. Ці властивості багато в чому залежать від кристалічних структур металів.
Завдяки металічному зв’язку окремі шари в кристалах металів можуть зміщуватися відносно один одного. Це надає металам пластичності (ковкості) — здатності змінювати свою форму без розриву хімічних зв’язків.
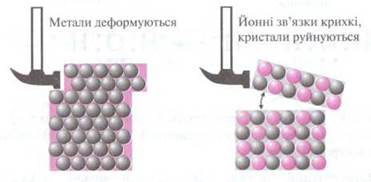
Рис.2.3 Порівняння процесів деформації речовин з магічно. та йонною кристалічними гратками
Найбільш ковким металом є золото — з 1 г золота можна витягнути дріт завдовжки 2,4 км і завтовшки в кількасот разів менший від товщини волосся. Водночас метал сурма дуже крихкий — його навіть можна розтирати на порошок у ступці.
Сплави
Оскільки різні метали мають подібні металічні зв’язки, а в ряді випадків утворюють подібні металічні кристали, то багато з них при переході в розплавлений стан можуть змішуватися один з одним, утворюючи сплави. Сплави мають більш різноманітні властивості порівняно з металами, тому в промисловості рідко використовують чисті метали.
У більшості випадків для виготовлення деталей різних машин та приладів застосовують сплави. Так, мідь, олово й цинк — це м’які метали, тимчасом як сплав на їхній основі — бронза — дуже твердий, тому бронзу люди здавна використовували для виготовлення зброї, плугів та інших виробів, де потрібна підвищена твердість. Сплав олова зі свинцем (третник) застосовують при паянні, тому що він має порівняно низьку температуру плавлення. Найпоширенішими зі сплавів є чавун і сталь — сплав заліза з вуглецем та іншими неметалами.
2.3 Хімічні властивості металів
1) Взаємодія з простими речовинами — неметалами.
2) Взаємодія з кислотами. Метали, що стоять у ряду стандартних електродних потенціалів до Гідрогену, витісняють водень із розбавлених кислот, окрім нітратної:
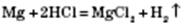
3) Взаємодія з солями. Активніші метали витісняють менш активні з розчинів їх солей:
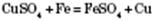
4) Взаємодія з водою.
Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню:
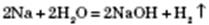
Метали, що стоять у ряду стандартних електродних потенціалів після Алюмінію, реагують із водою під час нагрівання з утворенням оксидів і водню:
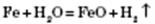
Метали, що стоять у ряду стандартних електродних потенціалів після Гідрогену, з водою не реагують.
5) Метали, гідроксиди яких амфотерні, реагують і з кислотами, і з основами:
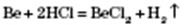
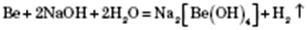
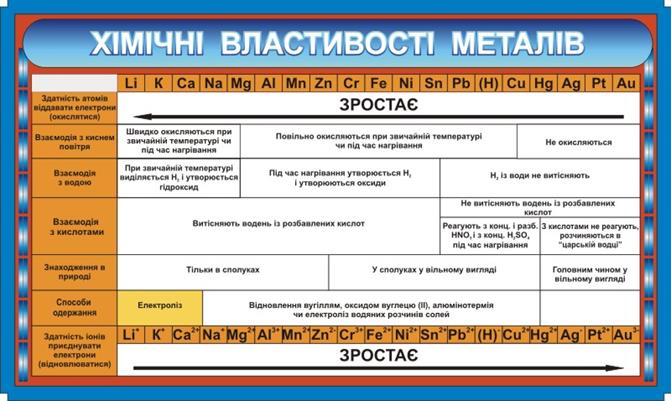
Рис.2.4 Електрохімічний ряд напруг металів (ряд активності металів) та хімічні властивості
Перелік тем для рефератів
| № | Тема | Орієнтовні пункти |
| 1. | Провідники першого роду | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 2. | Напівпровідники. | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 3. | Діелектрики | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 4. | Хімічні джерела струму | Електроліти – це. Хімічні джерела струму – це. Застосування та приклади |
| 5. | Гальванічний елемент | Принцип роботи гальванічного елементу. гальванопластика |
| 6. | Хромування, нікелювання | Принцип. Приклади. Сфери застосування |
| 7. | Електрохімічна корозія | Корозія – це,електрохімічна корозія – це. Електрохімічна корозія на залізничному транспорті, причини виникнення |
| 8. | Методи захисту від електрохімічної корозії | Корозія – це,електрохімічна корозія – це. Методи захисту від електрохімічної корозії |
| 9. | Принцип роботи свинцевого акумулятора | Свинцевий акумулятор. Будова акумулятора, характеристика складових, принцип дії, процеси розрядки та зарядки |
| 10. | Принцип роботи літій-іонних батарей | Літій-іонні батареї, складові частини, принцип роботи, процеси зарядки та розрядки. |
| 11. | Полімерні матеріали на залізничному транспорті | Полімери – це, застосування полімерних матеріалів на залізничному транспорті |
|
| <== предыдущая лекция | | | следующая лекция ==> |
| Благодарности. Моими главными консультантами по истории являлись Сэм Кон, Джефри Хиндли и Мерилин Ливингстон | | | Хімічні властивості металів |
Дата добавления: 2014-11-30; просмотров: 5093;
