Хімічні властивості металів
Оскільки різні метали мають подібні металічні зв’язки, а в ряді випадків утворюють подібні металічні кристали, то багато з них при переході в розплавлений стан можуть змішуватися один з одним, утворюючи сплави. Сплави мають більш різноманітні властивості порівняно з металами, тому в промисловості рідко використовують чисті метали.
У більшості випадків для виготовлення деталей різних машин та приладів застосовують сплави. Так, мідь, олово й цинк — це м’які метали, тимчасом як сплав на їхній основі — бронза — дуже твердий, тому бронзу люди здавна використовували для виготовлення зброї, плугів та інших виробів, де потрібна підвищена твердість. Сплав олова зі свинцем (третник) застосовують при паянні, тому що він має порівняно низьку температуру плавлення. Найпоширенішими зі сплавів є чавун і сталь — сплав заліза з вуглецем та іншими неметалами.
Хімічні властивості металів
1) Взаємодія з простими речовинами — неметалами.
2) Взаємодія з кислотами. Метали, що стоять у ряду стандартних електродних потенціалів до Гідрогену, витісняють водень із розбавлених кислот, окрім нітратної:
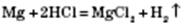
3) Взаємодія з солями. Активніші метали витісняють менш активні з розчинів їх солей:
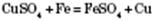
4) Взаємодія з водою.
Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню:
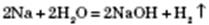
Метали, що стоять у ряду стандартних електродних потенціалів після Алюмінію, реагують із водою під час нагрівання з утворенням оксидів і водню:
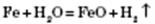
Метали, що стоять у ряду стандартних електродних потенціалів після Гідрогену, з водою не реагують.
5) Метали, гідроксиди яких амфотерні, реагують і з кислотами, і з основами:
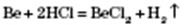
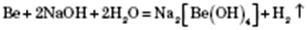
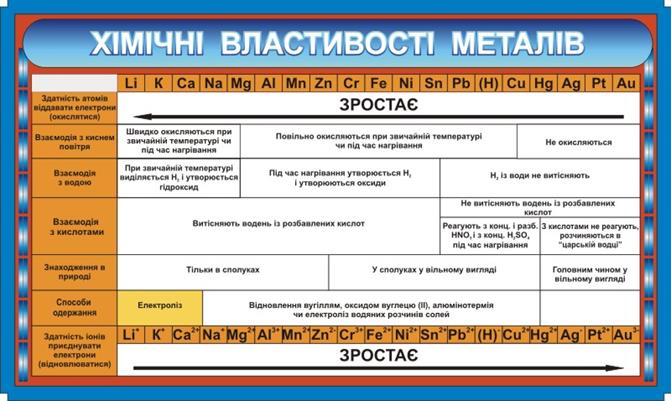
Рис.2.4 Електрохімічний ряд напруг металів (ряд активності металів) та хімічні властивості
Перелік тем для рефератів
| № | Тема | Орієнтовні пункти |
| 1. | Провідники першого роду | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 2. | Напівпровідники. | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 3. | Діелектрики | Визначення. Особливості будови. Принцип роботи. Приклади та застосування. |
| 4. | Хімічні джерела струму | Електроліти – це. Хімічні джерела струму – це. Застосування та приклади |
| 5. | Гальванічний елемент | Принцип роботи гальванічного елементу. гальванопластика |
| 6. | Хромування, нікелювання | Принцип. Приклади. Сфери застосування |
| 7. | Електрохімічна корозія | Корозія – це,електрохімічна корозія – це. Електрохімічна корозія на залізничному транспорті, причини виникнення |
| 8. | Методи захисту від електрохімічної корозії | Корозія – це,електрохімічна корозія – це. Методи захисту від електрохімічної корозії |
| 9. | Принцип роботи свинцевого акумулятора | Свинцевий акумулятор. Будова акумулятора, характеристика складових, принцип дії, процеси розрядки та зарядки |
| 10. | Принцип роботи літій-іонних батарей | Літій-іонні батареї, складові частини, принцип роботи, процеси зарядки та розрядки. |
| 11. | Полімерні матеріали на залізничному транспорті | Полімери – це, застосування полімерних матеріалів на залізничному транспорті |
|
Дата добавления: 2014-11-30; просмотров: 2453;
