Химиялық реакцияның жылдамдығы
Жұмыстың мақсаты
 Химиялық реакцияның жылдамдығының заттардың концентрациясына және температураға тәуелді екенін зерттеу.
Химиялық реакцияның жылдамдығының заттардың концентрациясына және температураға тәуелді екенін зерттеу.
Жұмыстың мазмұны
а) Тиокүкірт қышқылының ыдырау жылдамдығының тиосульфаттың концентрациясына байланысты өзгеруі;
в) Тиокүкірт қышқылының ыдырау жылдамдығының температураға байланысты өзгеруі.
Жұмыстың теориялық негіздері
Химиялық реакцияның жылдамдығы дегеніміз – уақыт бірлігіндегі заттың концентрациясының өзгерісі.
υ = (c2 – c1)/ (t2 - t2) =Dc/Dt
Химиялық реакцияның жылдамдығына көптеген факторлар әсер етеді: реагенттердің концентрациясы, температура, катализатор, сыртқы басқа да әсерлер, әрекеттесуші заттардың табиғаты.
Химиялық реакциялардың концентрацияға тәуелділігі әрекеттесуші массалар заңы арқылы өрнектеледі. Заң: “Химиялық реакциялардың жылдамдығы әрекеттесуші заттардың стехиометриялық коэффициенттерінің дәрежесіндегі концентрацияларының көбейтіндісіне тең”.
aА + bВ = сС
реакциясы үшін, әрекеттесуші массалар заңының формуласы мынадай:
υ =k caAcbB
Химиялық реакциялардың температураға тәуелділігі Вант-Гофф ережесімен сипатталады: “Температураны әрбір 100С ұлғайтқанда, химиялық реакцияның жылдамдығы 2-4 есе артады”.
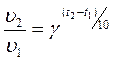
Бұл жұмыста химиялық реакцияның жылдамдығы тиокүкірт қышқылының ыдырау реакциясы арқылы зерттелінеді. Тиосульфат натрийға күкірт қышқылын қосқанда төмендегідей реакция жүреді:
Бұл жұмыста химиялық реакцияның жылдамдығы тиокүкірт қышқылының ыдырау реакциясы арқылы зерттелінеді. Натрий тиосульфатына күкірт қышқылын қосқанда төмендегідей реакция жүреді:
Дата добавления: 2014-12-08; просмотров: 4447;
