Зависимость скорости реакции от температуры
Скорость большинства химических реакций с повышением температуры возрастает. Это зависимость приближённо описывается эмпирическим правилом Вант-Гоффа: при повышении на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза.
Математически правило Вант-Гоффа можно выразить следующей математической зависимостью:
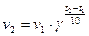 , (96)
, (96)
где v1 – cкорость реакции при температуре t1; v2 – скорость реакции при температуре t2; γ – температурный коэффициент скорости, равный 2-4 для разных реакций.
Более точно зависимость константы скорости от температуры описывается уравнением Аррениуса:
k = P·Z·e 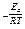 , (97)
, (97)
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объёма за единицу времени), измеряется в единицах константы скорости; R – газовая постоянная, кДж/моль∙К; Т – абсолютная температура, К; Еа – энергия активации, кДж/моль.
Под энергией активации понимают минимальный избыток энергии (по сравнению с величиной средней энергии молекул), которым должны обладать молекулы для того, чтобы реакция между ними стала возможной. Такие молекулы называются активными.
Множитель e 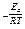 называют экспоненциальным; он характеризует долю активных столкновений молекул от их общего числа. Из уравнения Аррениуса вытекает, что доля активных столкновений, а, значит, и константа скорости тем больше, чем меньше энергия активации и чем выше температура. С увеличением температуры повышается кинетическая энергия молекул, а, следовательно, и доля активных молекул.
называют экспоненциальным; он характеризует долю активных столкновений молекул от их общего числа. Из уравнения Аррениуса вытекает, что доля активных столкновений, а, значит, и константа скорости тем больше, чем меньше энергия активации и чем выше температура. С увеличением температуры повышается кинетическая энергия молекул, а, следовательно, и доля активных молекул.
В уравнение Аррениуса введён также поправочный множитель Р (стерический фактор), учитывающий ориентацию сложных молекул в пространстве в момент столкновения по отношению друг к другу. Чем сложнее участвующие в реакции молекулы, тем меньше Р, а значит, и скорость реакции.
Уравнение Аррениуса можно представить также в виде:
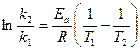 , (98)
, (98)
где k1, k2 – константы скорости соответственно при температурах Т1 и Т2.
Уравнение (98) используют для вычисления константы скорости реакции при заданной температуре, если известна величина её для другой (близкой) температуры и величина Еа. Интервал температур Т1 и Т2 необходимо брать близким, так как в широком диапазоне Еа заметно изменяется. Можно также по двум константам скоростей, измеренным при двух близких температурах, вычислить энергию активации данной реакции.
Пример 14. Реакция между веществами А и В выражается уравнением
2А + В → С
Начальная концентрация вещества А равна 3,2 моль/л, а вещества В – 1,6 моль/л. Константа скорости реакции 0,75. какова скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,5 моль/л?
Решение. Используем уравнение (86) для вычисления скорости реакции в начальный момент
v0 = k ·(с 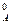 )2 ·с
)2 ·с 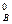 = 0,75·(3,2)2·1,6 = 12,29.
= 0,75·(3,2)2·1,6 = 12,29.
По истечении некоторого времени, когда концентрация вещества А уменьшится на 0,5 моль/л, концентрация вещества В (в соответствии с уравнением химической реакции) должна уменьшится на 0,25 моль, т.е.
сВ = 1,6 – 0,25 = 1,35 моль/л.
Следовательно, скорость реакции станет равной
v1 = k ·(с 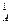 )2 ·с
)2 ·с 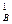 или
или
v1 = 0,75 · (2,7)2 · 1,35 = 7,38.
Пример 15. Реакция разложения пероксида водорода в водном растворе протекает как реакция первого порядка. Период полураспада при данном условии равен 15,86 мин. Определить, какое время потребуется для разложения (при заданных условиях) 99% пероксида водорода.
Решение. По периоду полураспада, используя выражение (91), вычислим константу скорости разложения перикиси водорода:
k = 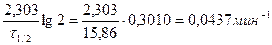 .
.
Зная константу, определяем время, за которое разложится 99% перекиси водорода:
k = 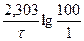 ;
; 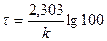 ;
;
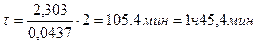
Пример 16. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится за 25 мин, если при 20ºС на это требуется 2ч. Температурный коэффициент скорости реакции равен 3.
Решение. Между константами скоростей и временем завершения реакции существует обратно пропорциональная зависимость
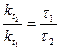 ,
,
где τ1 и τ2 – время завершения реакции при температурах t1 и t2.
Тогда уравнение (96) можно записать
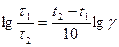 ,
,
откуда
t2 – t1 = 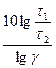 ,
,
а t2 = 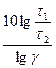 + t1 =
+ t1 = 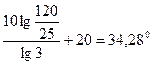 .
.
Пример 17. Для одной из реакций опытным путём были определены две константы скорости при 443ºС – 0,0067, а при 508ºС – 0,1059. Определить энергию активации данной реакции.
Решение. Используя формулу (98), откуда получаем
Еа = 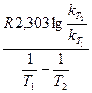 ,
,
или
Еа = 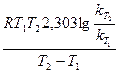 ,
,
Т1 = 443 + 273 = 716 К; Т2 = 508 + 273 = 781 К; R = 8,314 Дж/(моль·К);
Еа = 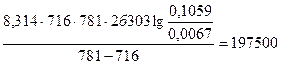 Дж/моль = 197,5 кДж/моль.
Дж/моль = 197,5 кДж/моль.
Вариант 1.
10. Рассчитайте среднюю скорость некоторой реакции, если за 10 мин концентрация реагента уменьшилась от 0,05 моль/дм3 до 0,01 моль/дм3.
11. При какой температуре период полупревращения равен 1 час, если энергия активации реакции равна 100 кДж/моль, а предэкспоненциальный множитель константы скорости равен 1013 с-1?
Вариант 2.
10. Для некоторой реакции при повышении температуры константа скорости изменяется следующим образом (табл.):
Таблица
| Т, К | |||
| k, моль-1∙дм3∙с-1 | 5,41·10-3 | 0,11 | 0,82 |
Найдите графическим и аналитическим методами энергию активации этой реакции.
11. Некоторая реакция при t=25ºC завершается за 2 часа. через какое время закончится эта реакция при t=75ºC, если её температурный коэффициент равен 2?
Вариант 3.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
(C2H5)3N + CH3I → CH3(C2H5)3NI
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10-2дм3/(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм3. Определить концентрацию триэтиламина через 5 часов после начала реакции.
11. Реакция разложения SO2Cl2:
SO2Cl2 = SO2 + Cl2
является реакцией первого порядка. При 552 К константа скорости реакции равна 0,609·10-4мин-1; а при 593 К – 13,20·10-4 мин-1. Рассчитайте период полупревращения этой реакции при 688 К.
Вариант 4.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
(C2H5)3N + CH3I → CH3(C2H5)3NI
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10-2дм3/(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм3. Определить время, в течение которого концентрация (C2H5)3N уменьшится в 1,5 раза.
11. Для реакции первого порядка:
N2O ↔ N2 + ½ O2
протекающей при температуре 1085 К, энергия активации равна 256,75 кДж/моль, предэкспоненциальный множитель константы скорости реакции равен 1,33·109 с-1. Определите время, в течение которого концентрация N2O изменится от 0,21 моль/дм3 до 0,07 моль/дм3.
Вариант 5.
10. Для некоторой реакции первого порядка период полупревращения составляет 2 года. Сколько потребуется времени, чтобы концентрация исходного вещества уменьшилась в 10 раз?
11. Для реакции, протекающей по уравнению:
СО + Н2О = СО2 + Н2
при 288 К константа скорости равна 0,31·10-3 дм3/(моль·мин). Энергия активации равна 97,06 кДж/моль. Чему будет равна константа скорости этой реакции при температуре 313 К?
Вариант 6.
10. Как изменятся скорости прямой и обратной реакции
4HCl + O2 ↔ 2 H2O(пар) + 2 Cl2
при увеличении давления в два раза и постоянной температуре?
11. При одинаковой концентрации реагирующих веществ скорость некоторой реакции, протекающей при 35ºC, в два раза выше, чем при 25ºC. Вычислить энергию активации данной реакции.
Вариант 7.
10. Во сколько раз увеличится скорость прямой реакции
2SO2 + O2↔ 2SO3
протекающей в закрытом сосуде, если увеличить давление в пять раз без изменения температуры?
11. Для реакции первого порядка А → С период полупревращения при 450 К равен 40 мин. Предэкспоненциальный множитель константы скорости реакции равен 5,4·1011с-1. Определить, чему равна величина энергии активации данной реакции.
Вариант 8.
10. В закрытом сосуде находится смесь газов, состоящая из 1 моль азота и 3 моль водорода, которая реагирует по уравнению
N2 + 3H2 ↔ 2NH3
Во сколько раз уменьшится скорость прямой реакции после того, как прореагирует 0,65 моль азота?
11. Энергия активации реакции второго порядка, протекающей при температуре 627 К,
2NO2 = 2NO + O2
равна 111,2 кДж/моль. Предэкспоненциальный множитель константы скорости реакции равен 3,36·109 дм3/(моль·с). Начальная концентрация NO2 равна 0,09 моль/дм3. Определите период полупревращения для этой реакции.
Вариант 9.
10. разложение закиси азота на поверхности золота при высоких температурах протекает по уравнению
N2O ↔ N2 + O
Константа скорости данной реакции 0,0005 при 900ºС. начальная концентрация закиси азота 3,2 моль/л. определить скорость реакции при указанной температуре в начальный момент и когда произойдёт разложение 78% закиси азота.
11. Константа скорости омыления уксусноэтилового эфира гидроксидом натрия при 282,6 К равна 2,37 дм3/(моль·мин), а при 287,6 К – 3,20 дм3/(моль·мин). При какой температуре константа скорости будет равна 4,00 дм3/(моль·мин)?
Вариант 10.
10. Реакция между веществами А и В протекает по уравнению
А + 2В ↔ С
Концентрация вещества А равна 1,5 моль/л, а В – 3 моль/л. Константа скорости реакции 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
11. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится в течение 20 мин, если при 20ºC на это требуется 3 ч. Температурный коэффициент скорости принять равным 2.
Дата добавления: 2014-12-07; просмотров: 4784;
