Мир кварков и глюонов
Глюоны дают внутри протона сильное ядерное взаимодействие, они являются той фундаментальной силой, которая связывает кварки. Спин глюона равен единице. И в зависимости от направления, в котором вращаются глюоны, можно было бы составить оставшуюся часть спина протона.
Измерить глюоны довольно непросто. Релятивистский коллайдер — единственная возможность это сделать, так как он единственный ускоритель частиц, который построен для столкновения «спин-поляризованных» протонов. То есть в нем спин всех частиц будет в одном направлении, когда они столкнутся. Так, к примеру, на более мощном швейцарском Большом адронном коллайдере спин частиц не выравнивается.
Взаимодействие двух столкнувшихся протонов контролируется мощной силой, и глюоны принимают в этом непосредственное участие. Если спин глюона — важная составляющая спина протона, то направление спинов сталкивающихся протонов влияет на результат. Ученые ожидали, что столкновение между двумя протонами, спины которых выровнены, произойдет на другой частоте, чем тогда, когда сталкиваются протоны со спинами, направленными в противоположные стороны. И последние данные с RHIC подтвердили: разница есть.
«Если нет определенных позиций, разница будет равна нулю, — говорит физик Хуан Рохо из Университета Оксфорда. — Если асимметрия не нулевая, распределение спина не будет тривиальным».
Команда Рохо рассчитала, что глюоны, вероятно, вносят половину спина в свойства протона.
Даниель де Флориан из Университета Буэнос-Айреса, опубликовавший в июле одну из новых работ на эту тему, вместе со своими коллегами проанализировал те же данные с RHIC. Но они применили другой математический анализ для расчета вклада глюонов. Однако выводы ученых схожи. Вклад спина глюонов в спин протона существенно важен.
«Эти данные впервые показали, что поляризация глюонов ненулевая; глюоны поляризованы. В принципе, они могут быть ответственны за остаток спина протона, но неопределенность крайне высока» – говорит Де Флориан.
№27 Электронная оболочка, подоболочки и уровни
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Квантовые характеристики электрона. Теория Бора приписывала четырем электронным оболочкам К, L, M и N квантовое число и, равное соответственно 1, 2, 3 и 4. Эти числа соответствуют повышающимся энергетическим уровням оболочек.
Однако внимательное рассмотрение атомных спектров показывает, что линии, обусловленные переходами между такими квантовыми энергетическими уровнями, на самом деле расщеплены на более тонкие линии. Это указывает, что электронные оболочки в действительности расщеплены на подоболочки, каждая со своим собственным квантовым энергетическим уровнем. Электронные подоболочки получили обозначения по типам соответствующих им линий в атомных спектрах, а именно:
s-подоболочка названа по «резкой» (sharp) s-линии р-подоболочка названа по «главной» (principal) р-линии d-подоболочка названа по «диффузной» (diffuse) d-линии f-подоболочка названа по «фундаментальной» (fundamental) f-линии
s-Подоболочка состоит из одной s-орбитали. р-Подоболочка состоит из трех р-орбиталей (см. рис. 1.18), а d-подоболочка-из пяти d-орбиталей.
Линии, обусловленные переходами между этими подоболочками, испытывают дальнейшее расщепление, если атомы элементов помещены во внешнее магнитное поле. Это расщепление называется эффектом Зеемана. Экспериментально установлено, что указанное расщепление возможно только для р-, d- и f-подоболочек. Каждый энергетический уровень, на который они расщепляются в магнитном поле, соответствует одной орбитали в подоболочке. Магнитное поле не оказывает влияния на s-подоболочку, так как она состоит всего из одной s-орбитали сферической формы.
В отсутствие магнитного поля все орбитали одной подоболочки имеют одинаковую энергию. Орбитали, имеющие одинаковую энергию, называются вырожденными.
Строение электронных оболочек атомов
Законы, по которым "живут"частицы микромира (электроны, нуклоны, атомы, молекулы) сильно отличаются от законов макромира (нашего мира – мира физических тел). Многое в поведении этих частиц наш мозг, эволюционировавший в макромире, просто не в состоянии себе представить. Поэтому с некоторыми особенностями таких частиц, особенностями, которые нам кажутся неожиданными и странными, нам придется просто смириться.
Из основного свойства заряженных тел и частиц следует, что неподвижными электроны в атоме быть не могут. Ведь в этом случае они, притянувшись к ядру, просто упали бы на него, и атом перестал бы существовать. Следовательно, электроны в атоме движутся. Но уже Резерфорду было ясно, что просто вращаться вокруг ядра электроны не могут. В то время уже были известны законы электродинамики, в соответствии с которыми вращающийся вокруг ядра электрон обязан постепенно терять свою энергию, что должно приводить в конце концов, к его падению на ядро. Эта исключительно сложная проблема хоть и не всегда последовательно, но была решена в первой трети ХХ века в результате работ многих выдающихся физиков: Нильса Бора, Альберта Эйнштейна, Эрвина Шрёдингера, Вернера Гейзенберга, Макса Борна и многих других ученых. С основными выводами из этих работ мы с вами и познакомимся.
Изучая электроны, атомы, молекулы, а также процессы их взаимодействия, мы будем использовать некоторые модели, позволяющие нам все же получить более или менее наглядное представление об изучаемых объектах. При этом необходимо помнить, что любая модель описывает реальность с той или иной степенью точности и может быть использована только в той области, для которой она создавалась.
Из частиц микромира нас интересует прежде всего электрон. И хотя свойства, проявляемые электроном в различных условиях, вы будете изучать в курсе физики, мы с вами кратко познакомимся стремя основными особенностями поведения электронов в атоме.
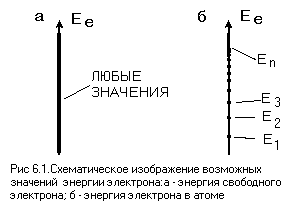 Первая особенность.Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения.
Первая особенность.Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения.
 Схематически это изображено на рис. 6.1, где слева на оси энергии жирной линией показаны возможные значения энергии свободного электрона, а справа на такой же оси отдельными точками – значения энергии электрона в атоме. Таким образом, электрон в атоме может находиться только во вполне определенных состояниях.
Схематически это изображено на рис. 6.1, где слева на оси энергии жирной линией показаны возможные значения энергии свободного электрона, а справа на такой же оси отдельными точками – значения энергии электрона в атоме. Таким образом, электрон в атоме может находиться только во вполне определенных состояниях.
При переходе электрона из одного состояния в другое энергия поглощается или выделяется порциями –квантами энергии. Поэтому первая особенность поведения электрона часто называется принципом квантования его энергии. Эта особенность была постулирована датским физиком Нильсом Бором в 1913 году и в дальнейшем получила блестящее экспериментальное подтверждение.
Вторая особенность. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства. Такая двойственность поведения электрона и других микрочастиц (дуализм) – одно из общих свойств материи (и вещества, и поля). Оно называется "корпускулярно-волновой дуализм"или "дуализм волна-частица ".
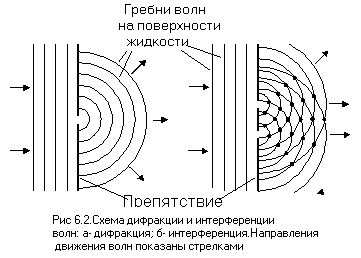
Волновые свойства электрона проявляются, например, при прохождении потока электронов через тончайшую кристаллическую пленку. Поток электронов ведет себя так, как будто через эту пленку прошли волны, то есть, подвергается дифракции(огибание волнами встречающегося на их пути препятствия ,если его размер сопоставим с длиной волны) и интерференции(увеличение гребней и уменьшение впадин волн при наложении их друг на друга) (смысл этих явлений понятен из рисунка 6.2, на котором показаны схемы дифракции и интерференции волн на поверхности воды при встрече препятствия с одним, или двумя отверстиями). Эту особенность поведения электрона предсказал французский физик Луи де Бройль в 1924 году, а в 1926 году американский физик Клинтон Девиссон впервые наблюдал дифракционную картину при взаимодействии потока электронов с металлами. В настоящее время волновые свойства электронов широко используются при исследовании строения различных веществ.
Третья особенность. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно определить его скорость.И наоборот, чем с большей точностью определяют скорость электрона(абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве.Это утверждение, а оно справедливо и для других микрочастиц, называется "принцип неопределенностей". Этот принцип был сформулирован немецким физиком Вернером Гейзенбергом в 1927 году. Принцип неопределенностей "лишает "летящий электрон траектории. Действительно, если мы в какой-то момент точно знаем положение электрона, то мы принципиально ничего не знаем о его скорости и в следующий момент времени можем обнаружить электрон в любой другой точке атома, правда, с разной вероятностью.
Теорию вероятностей изучает математика, а мы лишь воспользуемся несколько упрощенным определением этого понятия.
| Вероятность– отношение числа событий с "благоприятным "исходом к общему числу событий. |
№28 КВАНТОВОМЕХАНИЧЕСКОЕ ОБЪЯСНЕНИЕ ТАБЛИЦЫ МЕНДЕЛЕЕВА
Периодическая таблица элементов, составленная Менделеевым в 1869 г., играет важную роль при исследовании структуры и свойств вещества. Законами классической физики и химии невозможно объяснить закономерности этой таблицы.
Только после появления квантовой механики эти закономерности были объяснены. Как известно, энергия электронов в многоэлектронных атомах, зависит от квантовых чисел 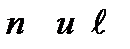 . Последовательность расположения электронных оболочек имеет вид:
. Последовательность расположения электронных оболочек имеет вид:
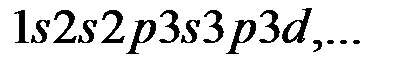 - это идеальное заполнение оболочек.
- это идеальное заполнение оболочек.
Опыты показывают, что начиная с 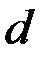 оболочек эта последовательность нарушается.
оболочек эта последовательность нарушается.
Для объяснения закономерностей таблицы Менделеева используется, так называемый, принцип построения:
1. Заполнение электронных оболочек начинается с орбитали с наименьшей энергией и продолжается по мере возрастания энергии.
2. Согласно принципу Паули, на каждой атомной орбитали (АО), с определенным набором квантовых чисел n.l и 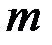 находится по 2 электрона с противоположными спинами.
находится по 2 электрона с противоположными спинами.
3. Правило Хунда. Для данной электронной конфигурации: наименьшей энергией обладает (уровень) терм, с наибольшей мультиплетностью, т.е. с наибольшим значением 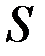 (полный спиновый момент или полный спин) и с наибольшим значением
(полный спиновый момент или полный спин) и с наибольшим значением 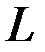 (суммарный орбитальный момент) при данной
(суммарный орбитальный момент) при данной 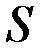 .
.
Используя эти правила, построим электронную конфигурацию некоторых атомов, начиная с водорода:
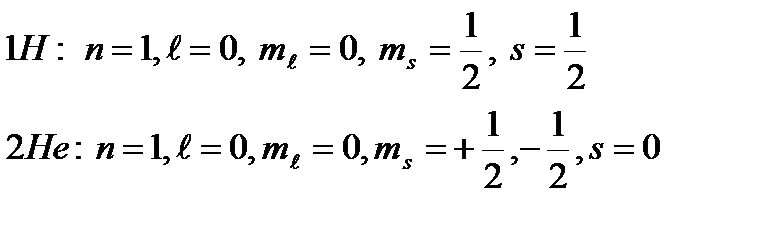
Третий электрон при заполнении электронных оболочек не может находиться на 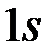 орбитали, в соответствии с принципом Паули.
орбитали, в соответствии с принципом Паули.
В атоме 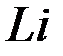 третий электрон находится либо на
третий электрон находится либо на 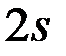 , либо на
, либо на 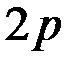 орбитали.
орбитали.
Экспериментально установлено, что энергия 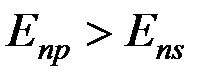 , однако:
, однако:
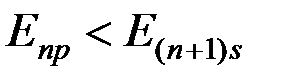
Таким образом, третий электрон 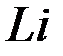 находится на
находится на 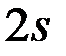 орбитали; тогда электронная конфигурация
орбитали; тогда электронная конфигурация 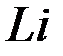 будет иметь вид:
будет иметь вид: 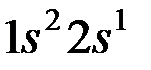
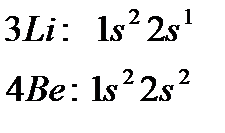
Квантовые числа четвертого электрона:
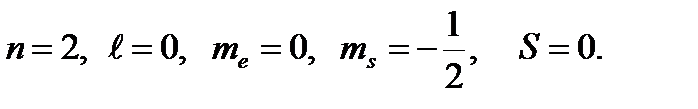
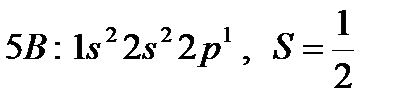
Известно, что 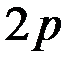 – орбитали состоят из 3-х эквивалентных орбиталей:
– орбитали состоят из 3-х эквивалентных орбиталей: 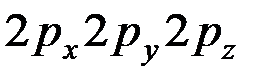 . Пятый электрон бора с одинаковой вероятностью может находиться в одной из них. Аналогичная картина имеет место в атоме углерода.
. Пятый электрон бора с одинаковой вероятностью может находиться в одной из них. Аналогичная картина имеет место в атоме углерода.
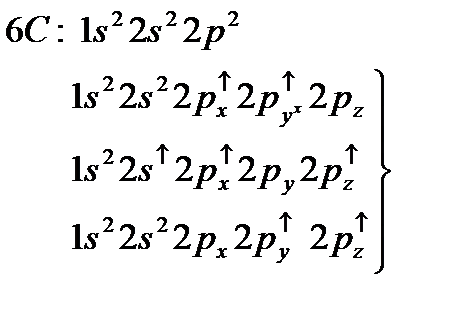
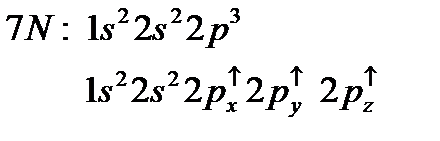
В некоторых случаях сперва заполняются оболочки с большим значением главного квантового числа n.
Для объяснения этого Клечковский предложил следующее правило:
Если для 2-х уровней энергии 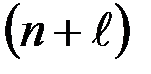 одинаково, то первым заполняется уровень с меньшим n например:
одинаково, то первым заполняется уровень с меньшим n например:
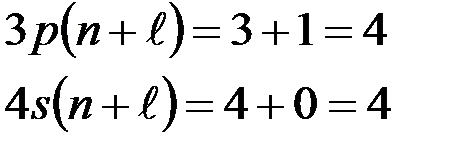
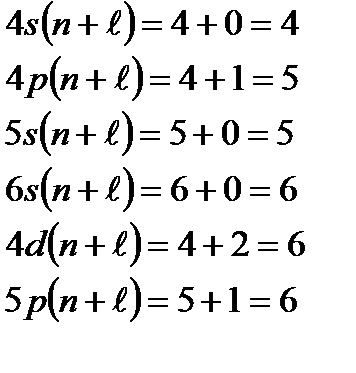
Используя правило Клечковского и принцип построения таблицы Менделеева, можно представить заполнение электронных оболочек следующим образом:
| Период | Электронное состояние | Число электронов |
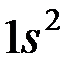
| ||
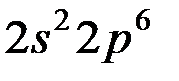
| ||
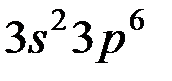
| ||
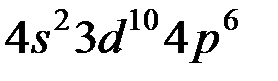
| ||
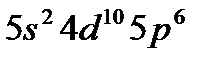
| ||
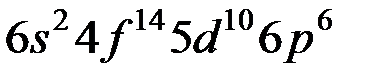
| ||
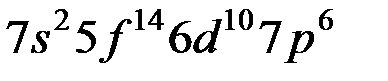 … …
| -- |
Таблица Менделеева состоит из 7 периодов. Первый элемент каждого периода входит в I группу. Всего групп – 8.
Каждый период начинается с заполнения 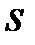 – оболочки и заканчивается заполнением
– оболочки и заканчивается заполнением 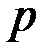 – оболочки.
– оболочки.
№ 29 6.4. Распределение Ферми-Дирака
Перейдем к анализу статистических свойств ферми-частиц, т.е. частиц, обладающих полуцелым спином. Напомним, что ферми-частицы подчиняются принципу (запрету) Паули, согласно которому в одном и том же состоянии одновременно не может находится более одного фермиона. Таким образом, фермионы являются частицами-индивидуалистами. Рассмотрим идеальный ферми-газ, т.е систему, состоящую из невзаимодействующих фермионов.
Как и в предыдущем параграфе решим сначала вспомогательную задачу - найдем число возможных распределений 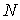 шаров по
шаров по 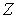 ячейкам пенала при условии, что в каждой ячейке не может находится более одного шара (рис. 6.5) . Темными кружками будем отмечать шары, находящиеся в ячейках, светлыми - отсутствие шара в ячейке. Число ячеек
ячейкам пенала при условии, что в каждой ячейке не может находится более одного шара (рис. 6.5) . Темными кружками будем отмечать шары, находящиеся в ячейках, светлыми - отсутствие шара в ячейке. Число ячеек 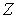 и число шаров
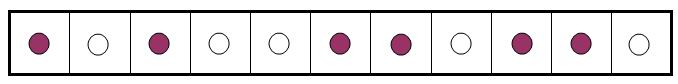
и число шаров 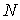 должны удовлетворять условию
должны удовлетворять условию 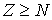 .
.
|
| Рис. 6.5. |
Число всевозможных перестановок черных и белых кружков по ячейкам пенала равно 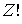 . При этом перестановки только черных кружков в силу тождественности частиц не приводят к новым распределениям. Число таких перестановок равно
. При этом перестановки только черных кружков в силу тождественности частиц не приводят к новым распределениям. Число таких перестановок равно 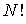 . Перестановки местами светлых кружков (пустых ячеек) тоже не дают новых распределений, их число равно
. Перестановки местами светлых кружков (пустых ячеек) тоже не дают новых распределений, их число равно 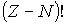 . Таким образом, число различных распределений
. Таким образом, число различных распределений 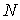 шаров по
шаров по 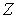 ячейкам в данном случае равно
ячейкам в данном случае равно
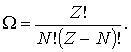
| (6.44) |
Для иллюстрации полученного результата рассмотрим распределение двух шаров по четырем ячейкам (рис.6.6). Число таких распределений равно
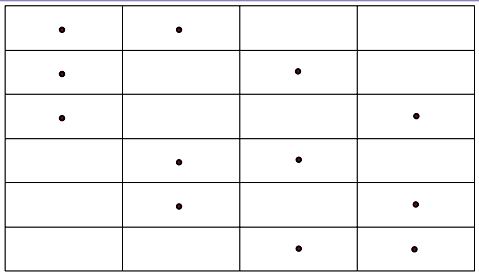
|
| Рис. 6.6. |
шести. Точно такой же ответ следует из (6.44)
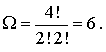
Поскольку фермионы в силу запрета Паули являются частицами-индивидуалистами, то выражение (6.44) определяет число возможных распределений 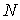 фермионов по
фермионов по  ячейкам, т.е. статистический вес макросостояния системы фермионов.
ячейкам, т.е. статистический вес макросостояния системы фермионов.
Вывод статистического распределения, которому подчиняются ферми-частицы, проводится подобно тому, как это было сделано выше для бозе-частиц. Рассмотрим шестимерное фазовое пространство с координатами 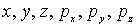 . Разобьем его с помощью изоэнергетических поверхностей
. Разобьем его с помощью изоэнергетических поверхностей
Дата добавления: 2014-12-06; просмотров: 2414;
