Растворы
Шлаки и сплавы представляют собой растворы, образование и процессы в которых подчиняются определенным законам. Рассмотрим основы теории растворов, которые относятся как к жидким, так и к твердым растворам.
В металлургических системах часто имеют дело с разбавленными растворами (любой промышленный сплав). Для анализа процессов в таких растворах за стандартное состояние для растворителя (металл – основа сплава) принимают реальное состояние чистого вещества, а в качестве раствора сравнения выбирают идеальный раствор, который подчиняется закону Рауля. Для примеси за стандартное состояние принимают условное состояние чистого вещества, в качестве раствора сравнения выбирают бесконечно разбавленный раствор, который подчиняется закону Генри.
Идеальным (или совершенным) считается раствор, в котором силы взаимодействия между одноименного атомами раствора равны силам взаимодействия разноименных атомов: FAA = FAB = FBB.
В силу этого образование раствора не сопровождается ни выделением, ни поглощением тепла, и объём идеального раствора равен сумме объёмов составляющих: V р-ра = V р-теяь + V раствор. в-ва.
Концентрацию компонентов идеального раствора выражается мольной долей N, которая представляет собой отношение числа молей одного компонента к общему числу молей в растворе. Идеальные растворы подчиняются закону Рауля, согласно которому
в идеальных растворах давление насыщенного пара при постоянной температуре прямо пропорционально концентрации вещества в растворе:
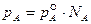 , (53)
, (53)
где 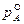 – давление насыщенного пара компонента А, находящегося в чистом виде при той же температуре, что и в растворе.
– давление насыщенного пара компонента А, находящегося в чистом виде при той же температуре, что и в растворе.
Бесконечно разбавленные растворы подчиняются закону Генри:
давление насыщенного пара растворенного вещества А при бесконечно малой концентрации NA→ 0, как в идеальном растворе, прямо пропорционально его концентрации (мольной доле):
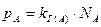 , (53)
, (53)
Отличие между законами Рауля и Генри заключается в значении коэффициента пропорциональности. В уравнении закона Рауля он имеет определенный физический смысл – это действительное давление пара над чистым веществом. В уравнении закона Генри - это эмпирическая величина, найденная из опыта для растворенного вещества в сильно разбавленных реальных растворах.
Свойства реальных растворов, как правило, отклоняются от свойств идеальных. Их образование обычно сопровождается тепловым эффектом и изменением объёма. Это связано с различием сил притяжения между одноименными и разноименными частицами, что приводит к упорядочению.
Давление насыщенного пара какого-либо компонента над неидеальным (реальным) раствором возрастает не пропорционально концентрации, а по сложным зависимостям двух типов.
1. Когда разнородные частицы А и В взаимодействуют между собой сильнее, чем однородные FAB > FAA (FBB), растворенные частицы удерживаются в конденсированной фазе прочнее, чем в идеальных растворах такого же состава. Давление насыщенного пара будет ниже, чем в том случае, если бы раствор был идеальным. Такие отклонения от идеальности (от закона Рауля) называются отрицательными. Образование подобных растворов - процесс экзотермический.
2. Когда силы связи между разнородными частицами в растворе слабее, чем между однородными FAB < FAA (FBB), стремление компонентов покинуть раствор будет выше, чем в идеальном растворе того же состава. Отклонения от идеальности в этом случае называются положительными. Растворение сопровождается поглощением тепла, и компоненты часто обладают ограниченной растворимостью. Одноименные частицы стремятся выделиться в самостоятельные группировки, что при определенных условиях ведет к расслоению систем на разные фазы.
В реальных растворах значения термодинамических потенциалов при данной температуре определяются не только концентрацией рассматриваемого вещества, но и природой и содержанием других компонентов.
Для неидеальных систем вместо аналитической концентрации NA используют активность компонента аА = γА · NA.
Коэффициент активности, как и сама активность, является сложной функцией состава, температуры и т.п. и в суммарном виде характеризует степень связанности частиц в растворе.
Чем прочнее вещество удерживается в смеси, тем меньше коэффициент активности и наоборот.
Дата добавления: 2014-12-05; просмотров: 1729;
