Гидролиз соли, образованной слабой кислотой и сильным основанием.
Рассмотрим пример гидролиза ацетата натрия:
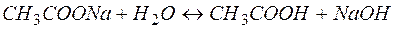 (9)
(9)
В ионной форме уравнение (9) примет вид:
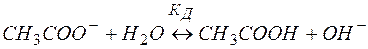 (10)
(10)
Поскольку результатом гидролиза является образование малодиссоциированного соединения СН3СООН, реакция, выраженная уравнением (9), принимает обратимый характер. Можно видеть, что результатом гидролиза является образование некоторого избыточного количества гидроксид–ионов. Таким образом, при гидролизе соли, образованной сильным основанием и слабой кислотой, среда становится щелочной ( 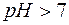 ).
).
В общем виде реакция гидролиза соли сильного основания и слабой кислоты по аналогии с (10) запишется
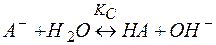 (11)
(11)
Константа равновесия гидролиза выражается через равновесные концентрации как
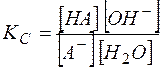 (12)
(12)
Преобразуем это выражение: 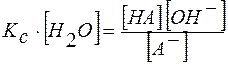 .
.
Так как 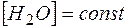 , то ее можно ввести в константу
, то ее можно ввести в константу 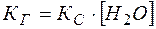 :
:
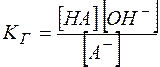 (13)
(13)
Константа 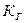 называется константой гидролиза.
называется константой гидролиза.
Умножая числитель и знаменатель правой части уравнения (13) на 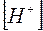 , получим
, получим
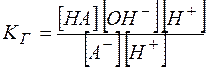
Можно видеть, что 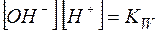 , а отношение
, а отношение 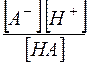 является константой диссоциации слабой кислоты. Таким образом,
является константой диссоциации слабой кислоты. Таким образом,
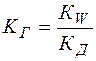 (14)
(14)
В соответствии с уравнением (8)
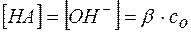 , и
, и 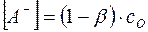 .
.
Подставляя эти значения в уравнение (13), имеем:
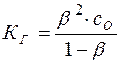 (15)
(15)
или:
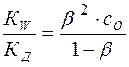 (16)
(16)
Обычно 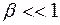 . Тогда уравнение (15) принимает вид:
. Тогда уравнение (15) принимает вид:
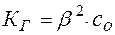 (17)
(17)
откуда следует, что
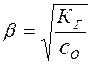 (18)
(18)
Тогда равновесная концентрация гидроксид-аниона составит:
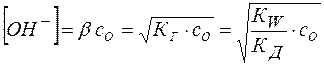 (19)
(19)
и
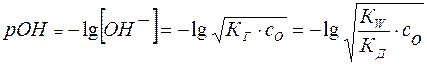
Отсюда легко рассчитывается рН раствора соли:
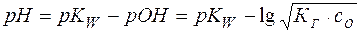 (20)
(20)
Если гидролизу подвергается многоосновный анион, то гидролиз протекает по стадиям:
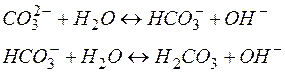
Константа гидролиза по первой ступени (Кг.1 = 2 . 10–4) значительно выше, чем по второй (Кг.2 = 2,2 . 10–8 ), поэтому, при расчете концентраций ионов [Н+] или [ОН–] второй (или третьей) ступенью гидролиза пренебрегают.
Дата добавления: 2014-12-05; просмотров: 1461;
