Катионообменная способность почв
Обменные катионы в почвах представлены главным образом элементами I и II групп периодической системы. В кислых почвах значительную, а иногда преобладающую роль играют ионы Н+ и А13+. В обменной форме в почвах находятся и многие микроэлементы: ионы Zn2+, Сu2+, Мn2+ и др.; эти формы микроэлементов учитывают при оценке их доступности растениям, но на физические и физико-химические свойства твердых фаз почвы и почвенного раствора они практически не влияют. Наиболее подробно катионный обмен изучен для катионов Са2+, Мg2+, К+ и Nа+.
Открытое Г.С. Томпсоном и впервые изученное Дж. Уэем явление обмена катионов в почвах оказало исключительно большое влияние на развитие химии почв и генетического почвоведения и привело к созданию искусственных ионообменников (ионитов), широко используемых в современной химии и химической технологии. Основы учения о ионном обмене и его использования в теоретическом и прикладном почвоведении создал выдающийся ученый академик К.К. Гедройц.
К.К. Гедройц рассматривал ионный обмен как один из видов поглотительной способности почв. Он предположил различать следующие виды поглотительной способности:
• механическая поглотительная способность — свойство почвы одерживать частицы, взмученные в фильтрующейся через почву воде;
• физическая поглотительная способность — концентрирование или разжижение растворенных в почвенном растворе веществ у поверхности соприкосновения твердых частичек почвы с почвенной влагой, обусловленное поверхностной энергией почвенных частиц;
• физико-химическая, или обменная, поглотительная способность, — свойство почвы обменивать некоторую часть содержащихся в твердых фазах катионов на эквивалентное количество катионов, находящихся в соприкасающемся с почвой растворе;
• химическая поглотительная способность — образование в почвенном растворе нерастворимых или малорастворимых солей, которые выпадают в осадок и примешиваются к твердым фазам почвы;
• биологическая поглотительная способность — обусловлена деятельностью растений и микроорганизмов, населяющих почвы, и заключается в поглощении живыми организмами различных веществ из почвенного раствора.
Эти виды поглотительной способности и основные закономерности обмена изложены К.К. Гедройцем в книге «Учение о поглотительной способности почв» (1922).
Катионообменная способность относится к числу фундаментальных свойств почвы. Ее роль и значение в неполном объеме можно охарактеризовать следующими положениями.
1. От состава обменных катионов зависят физические свойства почв: их пептизируемость и агрегированность. Обменный Na+ вызывает пептизацию тонкодисперсной части почв, образование почвенной корки, ухудшает структуру. Обменный Са2+ повышает степень агрегированности, способствует формированию водопрочной структуры.
2. От состава обменных катионов зависят поглощение органических веществ твердыми фазами, образование органоминеральных соединений.
3. Реакции обмена катионов влияют на рН почвенного раствора и его солевой состав.
4. Обменные катионы — один из непосредственных источников элементов минерального питания растений. В частности, обеспеченность почв калием определяется по содержанию обменного калия.
5. Состав обменных катионов — один из важнейших показателей, используемых при диагностике и классификации почв. Еще в работе В.В. Докучаева «Материалы к оценке земель Нижегородской губернии» указывалось, что поглотительная способность почв должна оказать большую услугу как масштаб для предварительного разделения почв на группы, при определении колебаний в пределах данной группы и для установки границ между соседними группами почв. К.К. Гедройц первым предложил использовать обменные катионы для генетической классификации почв. В современной практике широко используется деление почв на насыщенные и ненасыщенные основаниями; при подразделении почв по степени солонцеватости учитывается доля Nа+ в составе обменных катионов.
6. Состав обменных катионов и его ожидаемое изменение учитывают при составлении проектов промывок засоленных почв и полива почв минерализованными водами.
7. Законы катионного обмена являются теоретической основой доя некоторых видов химической мелиорации почв — известкования кислых почв и гипсования солонцов.
Катионный обмен — частный случай ионного обмена, под которым в химии понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами.
Реакцию обмена катионов М 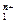 и М
и М 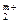 формально можно записать так:
формально можно записать так:
П(М 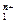 )m + nМ
)m + nМ 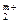 ↔ П(М
↔ П(М 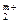 )n + mМ
)n + mМ 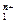 ,
,
где П — почвенный поглощающий комплекс. Эта форма записи показывает, что составная часть почвы — ее поглощающий комплекс, обозначаемый символом П (или ППК),— отдает в раствор катионы в обмен на эквивалентное количество катионов другого рода. Например, при обмене ионов Са2+ и Na+
ПСа2+ + 2Nа+ ↔ ПNа+2 + Са2+ или А13+ и Са2+
П(А13+)2 + 3Са2+ ↔ П(Са2+)3 + 2А13+.
Материальным носителем катионообменной способности почв является ППК. Почвенный поглощающий комплекс — это совокупность минеральных, органических и органоминеральных компонентов твердой части почвы, обладающих ионообменной способностью. Согласно определению, в ППК входят и способные к обменным реакциям катионы; в противном случае этот комплекс не смог бы выделить в ходе реакции эквивалентное количество катионов в обмен на катионы почвенного раствора. Не все твердые фазы почв способны проявлять катионообменную способность. Практически не обладают обменной способностью такие минералы, как кварц; очень слабо проявляется это свойство во фракциях механических элементов крупнее 0,002—0,005 мм. Способность к поглощению и обмену катионов сосредоточена главным образом в илистой фракции почв.
Катионы, которые входят в состав ППК и могут быть замещены Катионами другого рода при взаимодействии с нейтральными растрами солей, называют обменными катионами, в качестве синонима употребляют термин поглощенные катионы. При характеристике ППК и обменных реакций часто используют термин обменные основания, под которым понимают только обменные катионы Са2+, Мg2+, К+ и Na+, тогда как в число обменных катионов входят кроме того, Н+, А13+ и др. Таким образом, обменные основания составляют только часть обменных катионов, хотя в большинстве степных и сухостепных почв практически весь фонд обменных катионов представлен обменными основаниями. Термин «обменные основания» нельзя признать удачным; по определению Бренстеда — Лоури, основаниями называют вещества, способные соединяться с ионами водорода. По Аррениусу, основание — вещество, повышающее в растворе концентрацию гидроксильных ионов. Основаниями, следовательно, являются не сами катионы Са2+, Nа+ и т. д., а их гидроксиды. Однако в литературе по почвоведению прочно укоренилось понятие «обменные основания», и этим термином приходится пользоваться, хотя терминологические неточности нередко приводят к неверной трактовке почвенно-химических процессов. Так, встречаются мнения, что поступление в почвы ионов Са2+, Мg2+, Na+ независимо от сопутствующего им аниона вызывает снижение уровня почвенной кислотности.
Важнейшей характеристикой почвенного поглощающего комплекса и почвы в целом является емкость катионного обмена (ЕКО). Как синоним употребляют термин «емкость поглощения». Последний термин менее строгий, и поэтому его не следует рекомендовать для использования в научно-исследовательской и производственной работе.
По К.К. Гедройцу, емкость поглощения определяется как сумма всех обменных катионов, которые можно вытеснить из данной почвы. Он считал, что для данной почвы это величина постоянная и может изменяться лишь с изменением природы самой почвы. Позже было установлено, что величина ЕКО существенно зависит от рН взаимодействующего с почвой раствора и несколько варьирует при замене одного вида насыщающего катиона на другой.
Под емкостью катионного обмена будем понимать общее количество катионов одного рода, удерживаемых почвой в обменном состоянии при стандартных условиях и способных к обмену на катионы взаимодействующего с почвой раствора. Величину емкости катионного обмена выражают в миллиграмм-эквивалентах на 100 г почвы или ее фракции. Согласно правилам Международной системы единиц (СИ), величина ЕКО, выраженная в сМ(р+) • кг-1 (сантимоли положительных зарядов в 1 кг почвы), численно совпадав с числом миллиграмм-эквивалентов на 100 г почвы.
Емкость обмена не следует отождествлять с суммой обменных катионов. Последняя определяется как общее количество катионов, вытесняемых из незасоленной и бескарбонатной почвы нейтральным раствором соли. Сумма обменных катионов характеризует природное состояние почвы, она может совпадать количественно с ЕКО, но может и существенно от нее отличаться. Поскольку ЕКО зависит от рН, для одной и той же почвы сумма обменных катионов может быть ниже, если почва имеет кислую реакцию, ЕКО — выше, если ее определяют с помощью буферного раствор при рН 8,2. Возможны и обратные зависимости.
Учитывая зависимость емкости обмена от рН и необходимость характеристики почвы не только в условно выбранном стандартном состоянии, но и в природной обстановке, следует различат три вида ЕКО:
• емкость катионного обмена стандартную определяют с помощью буферных растворов при постоянном значении рН. С этой целью почву насыщают ионами Ва2+ из буферного раствора с рН 6,5 После насыщения емкость определяют по количеству поглощенно го почвой Ва2+;
• емкость катионного обмена реальную (или эффективную) определяют путем обработки почвы небуферными растворами солей о реальной емкости катионного обмена можно судить с достаточной точностью по сумме обменных катионов;
• дифференциальная (или рН-зависимая) емкость катионного обмена характеризует приращение емкости катионного обмена с увеличением рН равновесного раствора: ?ЕКО/DрН. Чтобы найти дифференциальную ЕКО, почву насыщают катионами одного рода из буферных растворов с различными значениями рН (например 6,5 и 8,2), а затем рассчитывают общее приращение ЕКО или её приращение на единицу рН.
Емкость катионного обмена зависит от гранулометрического состава почвы и строения веществ, входящих в состав почвенного поглощающего комплекса. Увеличение ЕКО в тяжелых по механическоскому составу почвах обусловлено не только нарастанием удельной поверхности, но и изменением природы слагающих различные фракции веществ. Предылистые и илистые фракции содержат слоистые алюмосиликаты, в них повышено содержание гумусовых веществ, для которых характерна более высокая плотность зарядов на единицу поверхности, чем для первичных минералов крупных фракций.
Величина ЕКО зависит от числа отрицательных зарядов, приходящихся на единицу массы или поверхности ППК. Обменные катионы компенсируют отрицательный заряд, и в отсутствие внешнего электрического поля каждая частица ППК электронейтральна.
Емкость катионного обмена составляющих почву веществ меняется в очень широких пределах: практически от нуля (обломки кварца) до 500—900 мг-экв/100 г для гуминовых кислот. Величина емкости зависит от состава ППК. Каолинит в зависимости от степени дисперсности обладает емкостью от 2 до 15 мг-экв/100 г, галлуазит — от 15 до 30 мг-экв, монтмориллонит — от 70 до 150 мг-экв, а после растирания—до 200—250 мг-экв/100 г. Емкость иллита порядка 20—30 мг-экв/100 г, слюды — около 5—10 мг-экв на 100 г.
Наибольшей емкостью обладают гумусовые вещества, для которых особенно сильно выражена зависимость ЕКО от рН. В нейтральной и кислой средах в реакциях обмена участвует водород только карбоксильных групп. В щелочной среде диссоциируют также фенольные группы и некоторые другие гидроксилы, что резко увеличивает ЕКО. Надо иметь в виду, что карбоксильные группы гумусовых кислот неодинаковы. Константы диссоциации групп СООН зависят от их положения в молекуле и ближайшего окружения. Способность водорода карбоксилов к диссоциации особенно сильно возрастает при наличии близко расположенных электроотрицательных заместителей. Часть групп СООН гумусовых кислот активно участвует в реакциях обмена катионов при рН 5—6; другие (более слабые) группы вступают в реакцию лишь при возрастании рН.
В обогащенных гумусом горизонтах почв величина ЕКО обусловлена в значительной мере органическими веществами. По данным М.А. Винокурова, емкость органической части почвы в 10—30 раз превышает ЕКО минеральной части, и при содержании гумуса около 5—6 % на его долю приходится 30—60 % ЕКО
При количественном описании явлений катионного обмена редко используют уравнения изотерм адсорбции, например уравнения Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассматривают как один из видов адсорбции. Однако различия между адсорбционными явлениями и ионным обменом настолько велики, что на этом следует остановиться подробнее.
Адсорбцией называют концентрированно вещества адсорбата объема газа или жидкости на поверхности твердого тела (адсорбе та) или жидкости. Если молекулы адсорбата образуют поверхностное химическое соединение с адсорбентом, то говорят о хемосорбции. Адсорбция увеличивается с ростом давления газа или концентрации раствора. При снижении парциального давления адсорбируемого компонента газовой смеси или при бесконечном разбавлении раствора адсорбция уменьшается вплоть до полного освобождения поверхности адсорбента от молекул адсорбата.
Сухие почвы обладают способностью адсорбировать различные газы и пары. Наиболее интенсивно происходит адсорбция молекул воды, которая описывается уравнением Брунауера — Эммета — Теллера (изотерма БЭТ). В меньшей степени адсорбируются СО2, O2, N2. Адсорбция воды, диоксида углерода и кислорода может сопровождаться химическим взаимодействием с компонентами твердых фаз почв (хемосорбция). Из растворов почвы адсорбируют нейтральные молекулы органических соединений, гумусовые вещества.
Адсорбцию вызывают молекулярные силы поверхности адсорбента Неполярные молекулы удерживаются за счет дисперсионных сил. Полярные молекулы (диполи, мультиполи) взаимодействуют с электростатическим полем поверхности адсорбента, что усиливает адсорбцию. Одно из главных различий между адсорбцией и ионным обменом заключается в том, что обменные катионы являются обязательным компонентом ППК и могут быть только заменены на катионы другого рода, но не удалены вовсе. Попытка пространственного расчленения ППК на анионную часть и катионы привела бы к нарушению принципа электронейтральности. В противоположность этому поверхность адсорбента может быть полностью лишена молекул адсорбата. Общее содержание обменных катионов остается сравнительно постоянным (в пределах постоянства величины ЕКО), тогда как количество адсорбированного вещества является функцией активности адсорбата в объеме фазы. Иными словами адсорбент и адсорбат могут существовать раздельно, тогда как ППК составляет единое целое.
В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции пользуются уравнением Фрейндлиха или уравнением Ленгмюра.
Эмпирическое уравнение Фрейндлиха имеет вид 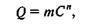
где Q — количество адсорбированного вещества; с — его равновесная концентрация (или равновесное парциальное давление); m и n -эмпирические константы. Это уравнение впервые было сформулировано Беммеленом в 1888 г., но в литературе закрепилось как уравнение Фрейндлиха. Оно хорошо описывает многие сорбционные процессы, хотя и не позволяет найти предельную величину максимальной адсорбции.
Уравнение Ленгмюра для мономолекулярной адсорбции записывают в следующем виде:
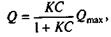
где Q— количество адсорбированного вещества на 1 г адсорбента; С - равновесная концентрация; C—константа равновесия; Qmax — максимальное количество вещества, адсорбируемое адсорбентом, его сорбционная емкость.
При изучении процессов поглощения почвами катионов, анионов, неполярных молекул широко используют представление о специфической и неспецифической адсорбции. Различие между ними определяется характером связи поглощенных почвой веществ с активными адсорбционными центрами на поверхностях твердых фаз.
Неспецифическая адсорбция обусловлена слабыми молекулярными (вандерваальсовыми и кулоновскими электростатическими, силами). Электрическое взаимодействие характерно для классического варианта ионного обмена, когда удерживаемые за счет электростатического взаимодействия катионы и анионы легко обмениваются на катионы и анионы равновесного почвенного раствора.
Такое взаимодействие характерно в чистом виде для катионов Nа+, Сs+, частично для К+, Са2+, Мg2+, Ва2+, а также для таких анионов, как Сl- и NO 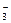 .Большинство важнейших анионов (Н2РО
.Большинство важнейших анионов (Н2РО 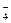 , НРО
, НРО 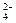 , SО
, SО 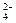 , SеO
, SеO 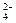 , F-), катионы щелочно-земельных металлов, катионы и гидроксиды практически всех тяжелых металлов в значительной мере или полностью поглощаются по механизму специфической адсорбции. Это означает, что при таком взаимодействии образуются значительно более прочные координационные и ковалентные связи с поверхностными соединениями или группами. Иногда отмечают, что хемосорбция отличается образованием еще более прочных связей. Связанные по механизму специфической адсорбции ионы не удается вытеснить катионами и анионами нейтральных солей по типу обычных реакций ионного обмена. При специфической адсорбции может поглощаться значительно большее количество ионов, чем это вытекает из ЕКО и уравнений обмена, причем уровень поглощения сильно зависит от рН.
, F-), катионы щелочно-земельных металлов, катионы и гидроксиды практически всех тяжелых металлов в значительной мере или полностью поглощаются по механизму специфической адсорбции. Это означает, что при таком взаимодействии образуются значительно более прочные координационные и ковалентные связи с поверхностными соединениями или группами. Иногда отмечают, что хемосорбция отличается образованием еще более прочных связей. Связанные по механизму специфической адсорбции ионы не удается вытеснить катионами и анионами нейтральных солей по типу обычных реакций ионного обмена. При специфической адсорбции может поглощаться значительно большее количество ионов, чем это вытекает из ЕКО и уравнений обмена, причем уровень поглощения сильно зависит от рН.
Специфически могут связываться также ионы К+ и NН 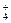 , в том числе в межпакетных пространствах минералов с расширяющейся решеткой, а также гидроксокомплексы катионов многих металлов. Все это осложняет анализ количественных закономерностей реакций ионного обмена.
, в том числе в межпакетных пространствах минералов с расширяющейся решеткой, а также гидроксокомплексы катионов многих металлов. Все это осложняет анализ количественных закономерностей реакций ионного обмена.
Дата добавления: 2014-12-02; просмотров: 5589;
