Соединения алюминия и проблема почвенной кислотности
Из элементов III группы периодической системы элементов Д.И. Менделеева только алюминий содержится в почвах в макроколичествах и играет важную конституционную роль. Остальные элементы могут быть отнесены к группе микро- и ультрамикроэлементов; в их числе существенное физиологическое и сельскохозяйственное значение имеет бор.
Среднее содержание А1 в земной коре составляет около 8 % (массовых); по А.Е. Ферсману — 7,45 %, по А.П. Виноградову — 8,05 %. Для алюминия характерна отчетливо выраженная концентрационная дифференциация в зависимости от породы. Ультраосновные породы содержат в среднем около 0,45 % А1, а в осадочных породах (глинах, сланцах) оно возрастает до 10—11 %. Кислые, средние и основные породы (граниты, диориты, базальты и т. п.) занимают промежуточное положение — 7—9 %.
В океанических водах концентрация А1 близка к 0,01 мг/л. В речных и озерных водах содержание алюминия несколько выше — 0,02—0,03 мг/л, а в щелочных водах при рН 9—11 концентрация его может достигать 0,5—0,7 мг/л. Наиболее высокая концентрация была найдена в подземных водах — до нескольких миллиграммов в литре.
В живых организмах в среднем содержится 5 • 10-3 % А1; в золе растений содержание его довольно высоко и может составлять до 1,4%.
На общий фоновый уровень содержания алюминия существенный отпечаток накладывает процесс почвообразования. В зависимости от типа почвы меняется как среднее содержание Аl в почвенной толще, так и его распределение по генетическим горизонтам. Повышено содержание Аl в бурых лесных суглинистых почвах до 8—9 %, в красноземах — до 14—15 %, а в латеритах содержание Аl2Оз может составлять до 50 % всей массы почвы (или около 26 % Аl). Столь высокое содержание Аl2O3 характерно для бокситов наиболее высоких промышленных марок (не менее 52 % А12О3; наиболее низкая промышленная марка боксита характеризуется содержанием А12О3 не менее 28 %).
Равномерное распределение А1 по профилю характерно для многих степных почв, особенно для черноземов. Значение алюминия в почвообразовании и плодородии почв определяется следующими положениями.
1. Высокое содержание А1 в почвах и его участие в формировании алюмосиликатов обусловливает его ведущую наряду с Si, О и С конституционную роль. Следует упомянуть, что алюмосиликаты — наиболее распространенные минералы, составляющие до 85 % массы земной коры. При этом какое-либо специфическое влияние Аl на морфологические признаки почв не выражено.
2. Алюминий обладает достаточно высокой реакционной и миграционной способностью и образует многообразные формы соединений. Он активно участвует в перераспределении вещества по почвенному профилю, а его соединения и их распределение по профилю могут быть использованы для диагностики почв и некоторых процессов.
3. Алюминий участвует в формировании потенциальной (обменной и гидролитической) кислотности почв.
4. Для растений небезразлично повышенное содержание подвижных соединений А1; в их присутствии образуются труднорастворимые фосфаты алюминия, фосфор которых при старении и кристаллизации осадков становится малодоступным растениям. Кроме того, алюминий токсичен для многих растений; уже при концентрации А1 в растворе около 2 мг/л наблюдается резкое ухудшение развития корневой системы, нарушается углеводный, азотный и фосфатный обмен в растениях. Более высокие концентрации алюминия вызывают резкое снижение урожая зерновых культур и даже их гибель.
Поведение А1 в почве обусловлено его положением в периодической системе элементов Д.И. Менделеева. Находясь в III группе периодической системы, алюминий имеет следующее распределение электронов в атоме:1s22р63s23р1.
Во всех встречающихся в почвах соединениях алюминий трехвалентен, хотя в очень жестких лабораторных условиях могут быть получены соединения, в которых А1 проявляет валентность 1+ и 2+.
Соединения алюминия
Алюминий в почвах представлен соединениями с резко различной растворимостью, а для почв гумидных областей (подзолистые, дерново-подзолистые, болотные, красноземные) характерно присутствие не только легкорастворимого, но и обменного алюминия. Обменный А1 присутствует обычно в количестве от десятых долей до 3—10 мг-экв/100 г почвы (т. е. от единиц до нескольких десятков миллиграммов на 100 г почвы).
Соединения алюминия в почвах очень разнообразны. Это оксиды и гидроксиды алюминия; содержащие алюминий минералы-соли; простые и комплексные соединения А1 с органическими веществами и, наконец, алюмосиликаты.
Оксид алюминия А12О3 встречается в породах в виде корунда, отличающегося высокой твердостью и устойчивостью к кислотам. Корунд имеет серую с синеватым или желтоватым оттенком окраску, но примеси Сr, Мn, Fе, Тi придают ему интенсивную красную, синюю или черную окраску. Окрашенные разновидности корунда относятся к числу известных драгоценных камней: сапфир, рубин, топаз и т. п. Корунд встречается в бокситах, сиенитах, пироксенитах, сланцах, гнейсах.
Несмотря на его устойчивость к кислотам в природной обстановке, корунд, по-видимому, постепенно трансформируется в диаспор или гиббсит.
Чаще других в почвах встречается гиббсит (или гидраргиллит) — А1(ОН)3, кристаллическая решетка которого построена из слоев алюмогидроксильных октаэдров (рис. 1). Формулу гиббсита иногда формально записывают в виде А12О3 • 3Н2О. Гидроксид алюминия может находиться в почвах как в окристаллизованном, так и в аморфном состоянии. Свежеосажденный Аl(ОН)3 не обнаруживает признаков кристаллического строения. В почвах и породах гиббсит образует шестиугольно-таблитчатые кристаллы правильной или неправильной формы, друзы, а также натечные формы и конкреции.
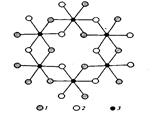
Рис. 1. Схема структуры гиббсита: 1— ОН, расположенные ниже плоскости чертежа; 2— ОН, расположенные выше плоскости чертежа; 3 — А1
Совместно с гиббситом или независимо от него встречается бёмит — γ-АlOОН и диаспор α-А1ООН (или НА1О2). Иногда в литературе можно встретить формальное написание формулы бёмита и диаспора в виде А12О3 • Н2О. Эти минералы более характерны для бокситов и древних аллитизированных тропических почв.
В природной обстановке образуются и в некоторых условиях накапливаются минералы-соли, содержащие алюминий. В почвенной среде такие соединения алюминия за небольшим исключением неустойчивы.
При испарении природных водных растворов образуются квасцы КА1(SО4)2 • 12Н2О. В кислых породах при воздействии сернистых газов образуется и накапливается квасцовый камень алунит КА13(SО4)2(ОН)6. В пегматитах и гнейсах встречается криолит Na3А1F6. Квасцы хорошо растворимы в воде, криолит хотя и слабо (порядка 0,03 %), но все же растворим, и поэтому, попадая в почву, такие минералы очень быстро трансформируются, переходя главным образом в различные гидроксиды.
Преобладающая часть алюминия в большинстве почв представлена силикатами, причем они являются и наиболее устойчивыми соединениями.
В числе силикатов, встречающихся в почвах, следует назвать безводные силикаты алюминия: силлиманит и дистен (или кианит). Состав этих минералов может быть выражен общей формулой Аl2SiO5 (иногда записывают в виде АlO • АlSiO4), различаются они формой кристаллизации. Эти минералы более характерны для метаморфических пород, в почвах сравнительно редки.
В крупных гранулометрических фракциях алюминий представлен различными ортосиликатами и полисиликатами. Для почв характерны мусковит, эпидот, микроклин, ортоклаз; плагиоклазы — альбит, анортит и промежуточные формы.
В тонкодисперсных фракциях почв алюминий, кроме оксидов и гидроксидов, представлен и слоистыми силикатами (их часто называют глинистыми или глинными минералами).
Многообразие форм соединений алюминия в почвах, как, впрочем, и ряда других элементов, делает практически невозможной и нецелесообразной попытку определения всех индивидуальных веществ, которые присутствуют в конкретной почве и содержат алюминий. Значительно удобнее и эффективнее использовать определение групп соединений, понимая под группой совокупность входящих в состав почвы веществ, обладающих одним или несколькими сходными (однотипными) свойствами.
По С.В. Зонну, различают следующие группы соединений алюминия:
1) силикатный алюминий, входящий в кристаллическую решетку алюмосиликатов;
2) свободный алюминий, не входящий в кристаллическую решетку силикатов. Свободный алюминий, в свою очередь, подразделяется на окристаллизованные и аморфные соединения алюминия.
Силикатный алюминий определяется по разности между валовым содержанием А1 и его количеством, переходящим в вытяжку 1 н. NaОН (по Дюшофуру — Сушье). Окристаллизованные соединения А1 извлекаются из почвы вытяжкой Тамма.
Кроме того, отдельно определяют содержание обменного А1, извлекаемого раствором 1 н. КС1, и так называемый экстрагируемый алюминий, извлекаемый ацетатно-аммонийным буферным раствором с рН 4,8.
Концентрация и состав соединений алюминия в почвенном растворе регулируются главным образом степенью кислотности или щелочности раствора.
Гидроксид алюминия проявляет типичные амфотерные свойства. В достаточно кислой среде он растворяется с образованием соли, содержащей катион алюминия А13+:
А1(ОН)3 + 3НС1 → А1С13 + 3Н2О
В щелочной среде образуются алюминаты. При реакции гидроксида алюминия с избытком щелочи образуются гидроксоалюминаты:
А1(ОН)3 + NаОН → Nа[А1(ОН)4]
Соли метаалюминиевой кислоты НА1О2 — метаалюминаты — образуются при сплавлении оксида алюминия со щелочью:
А12О3 + 2КОН → 2КА1O2 + Н2О
В промежуточном интервале рН в растворе присутствуют различные частицы алюминия: А13+ (или Аl(Н2О) 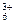 ), А1OН2+, А1(ОН)
), А1OН2+, А1(ОН) 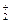 , А1(ОН)3, А1(ОН)
, А1(ОН)3, А1(ОН) 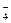 .
.
Все эти особенности позволяют записать реакцию растворения гидроксида алюминия в следующей общей форме:
qА1(ОН)3(тверд) ↔Аlq(ОН) 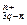 + nОН-,
+ nОН-,
где q выражает степень полимеризации соответствующих ионов, а n — их заряд. Соответствующую константу реакции К можно записать в виде
K= 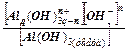
где квадратные скобки означают активности компонентов. Принимая, что активность гидроксида в твердой фазе равна единице, и обозначая отрицательный логарифм символом р, получим
рК=р 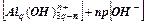
Концентрация А1 в почвенном растворе обусловлена веществами, которые находятся в твердых фазах. Наибольшей растворимостью обладает свежеосажденный гидроксид алюминия А1(ОН)3; растворимость минералов (пород) уменьшается в ряду
А1(ОН)з > гиббсит = боксит > диаспор.
При растворении любых алюминийсодержащих минералов — гиббсита, бёмита, диаспора — переходящие в раствор ионы алюминия образуют осадок А1(ОН)3, если будет достигнуто соответствующее произведение растворимости. Тогда концентрация А1 в растворе будет отвечать растворимости свежеосажденного А1(ОН)3. Поскольку в водной среде всегда имеются гидроксильные ионы, а значение рН почвенных растворов ниже 4 встречается редко, то для алюминия регулирующим концентрацию компонентом является преимущественно А1(ОН)3.
Исходя из изложенных выше представлений можно сделать заключение о способности алюминия к миграции в почвенном профиле и о формах, в которых алюминий реально может мигрировать.
Возьмем за основу гидроксид алюминия, произведение растворимости которого равно 5 • 10-33. Величина ПР позволяет вычислить концентрацию ионов А13+ при любых значениях рН.
По Л.Н. Александровой, алюминий образует комплексные соли гумусовыми кислотами, входя при этом в анионную часть молекулы. Формулы таких соединений могут быть записаны в следующем виде'
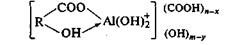 или
или

Участие карбоксильных групп гумусовых кислот в образовании таких соединений подтверждено Л.Н. Александровой прямым определением их количества в соответствующих соединениях.
По Л.Н. Александровой, часть алюминия, входящего в состав алюмогуминовых соединений, не способна к обменным реакциям, а часть вытесняется катионом нейтральной соли. Это говорит о двойственной природе алюминия в алюмогуминовых соединениях: часть алюминия входит во внутреннюю сферу молекулы и не способна к реакциям обмена катионов, другая часть алюминия замещает водород функциональных групп и вступает в реакции катионного обмена. Это можно иллюстрировать общей формулой вида:
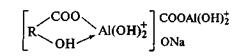
Экспериментальные данные показывают, что при участии А1 как и Fе, возможны реакции трех типов:
1) участие в реакции одной карбоксильной группы СООН и одной фенольной группы ОН:
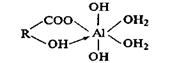
где R — радикал гуминовои кислоты;
2) участие в реакции двух карбоксильных групп:
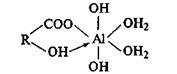
3) участие только одной карбоксильной группы, способной занимать два координационных места:
ВИДЫ ПОЧВЕННОЙ КИСЛОТНОСТИ
Одна из важнейших функций алюминия в почвах связана с формированием почвенной кислотности; выяснение вопроса о природе почвенной кислотности и роли алюминия в ее проявлении вызвало одну из наиболее острых и длительных дискуссий по проблемам химии почв.
Кислотность почв проявляется в разных формах и обусловлена помимо алюминия другими элементами и соединениями. В настоящее время различают следующие формы или виды почвенной кислотности: 1) актуальная кислотность; 2) потенциальная кислотность, которая подразделяется на обменную и гидролитическую кислотность.
Актуальная кислотность. Эта форма кислотности наиболее проста для понимания; так называют кислотность почвенного раствора, обусловленную растворенными в нем компонентами.
На практике редко измеряют рН почвенного раствора. Вместо этого анализируют водные вытяжки или водные суспензии почв. Согласно решению II Международного конгресса почвоведов, водные вытяжки и суспензии для измерения рН готовят при отношении почва : вода, равном 1 : 2,5. Для торфянистых почв и торфов это отношение расширяют до 1 : 25.
Степень кислотности почвенных растворов, вытяжек и суспензий оценивают величиной рН, количество кислотности — по содержанию титруемых щелочью веществ, обладающих кислотными свойствами.
Кислотность почвенных растворов обусловлена присутствием свободных органических кислот или других органических соединений, содержащих кислые функциональные группы, свободных минеральных кислот (главным образом угольной кислоты), а также других компонентов, проявляющих кислотные свойства. В числе последних наибольшее влияние оказывают ионы А13+ и Ре3+, причем их кислотные свойства соизмеримы с кислотными свойствами таких кислот, как угольная и уксусная.
По данным И.Н. Скрынниковой, в кислых почвенных растворах дерново-подзолистых почв содержатся:
• свободные нелетучие органические кислоты;
• соли сильных оснований и слабых органических кислот;
• свободный СО2 и соли угольной кислоты;
• аммонийные соли слабых органических кислот. Сочетание этих компонентов в почвенных растворах обусловливает значение рН в интервале 4,2—6,8.
Дата добавления: 2014-12-02; просмотров: 5998;
