Строение и классификация ферментов
В 1946 г. Самнер и Нортроп получили Нобелевскую премию за выделение в кристаллическом виде первого фермента - уреазы. Так было бесспорно доказано, что биологические катализаторы представляют собой белки.
В 1963 г. была расшифрована первичная структура лизоцима - фермента животного происхождения. Было установлено, что этот белок состоит из 129 аминокислот.
В 1965 г. Филлипс при помощи рентгеноструктурного анализа определил пространственную структуру лизоцима.
Ферменты (энзимы) – катализаторы белковой природы, образующиеся и функционирующие во всех живых организмах. Ферменты не изменяются и не расходуются в процессе реакции, ускоряют только те реакции, которые могут протекать и без них. Скорость протекания реакции при участии ферментов на несколько порядков выше, чем под влиянием химических катализаторов. Для ферментативных реакций характерен почти 100 % выход продукции. В настоящее время в природе обнаружено свыше 3 тысяч ферментов.
Ферменты представляют собой полипептидную цепь - «скелет», в которой имеются дисульфидные мостики, придающие особую прочность пространственной структуре молекулы фермента. В ней имеются также непрочные водородные мостики между соседними атомами кислорода и водорода различных аминокислот. Молекулы ферментов небольшие, плотно «уложены», содержат всего лишь 20-30 % воды. Полярные группы аминокислот находятся в основном на поверхности фермента, что обеспечивает его хорошую растворимость а воде. На одном из участков поверхности фермента сосредоточены неполярные аминокислотные группы. Эти группы образуют активный центр фермента. В контакт с субстратом вступает только активный центр фермента, обычно состоящий из 3-12 аминокислотных остатков (рис. 6).
 Основная функция остальных аминокислот состоит в придании ферменту специфической формы (поддержании глобулярной четвертичной структуры), от которой зависит эффективность работы активного центра фермента.
Основная функция остальных аминокислот состоит в придании ферменту специфической формы (поддержании глобулярной четвертичной структуры), от которой зависит эффективность работы активного центра фермента.
Ферменты очень специфичны. Фишер в 1890 году высказал гипотезу «ключа и замка»(рис. 7), в которой он объяснил такую специфичность точным соответствием формы субстрата форме активного центра фермента, как ключ соответствует замку.
Рис. 6. А. Схематическое изображение фермент-субстратного комплекса. Б. Положение аминокислот, образующих активный центр фермента, в первичной структуре ферментного белка

Образованные в результате ферментации продукты отделяются от активного центра фермента поступают в окружающую среду, после чего фермент может вновь вступает в реакцию с субстратом.
Рис. 7. Схема Фишеровской гипотезы «ключа и замка»
В 1959 году Кошланд сформулировал гипотезу «индуцированного соответствия», согласно которой молекула субстрата, взаимодействуя с ферментом, вызывает изменения в его структуре. Поэтому аминокислоты активного центра фермента принимают определенную форму, позволяющую ферменту наиболее эффективно выполнять свою функцию (рис. 8).
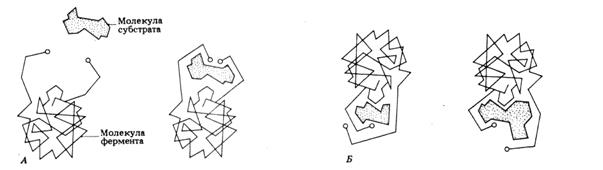
Рис. 8. Схема, иллюстрирующая кошландовскую гипотезу «индуцированного соответствия». А. Соединяясь с ферментом субстрат вызывает в нем изменения, в результате которых активные группы фермента сближаются. Б. Более мелкие или более крупные молекулы не способны взаимодействовать с ферментом.
В белковой части молекулы фермента может находиться и аллостерический центр, который влияет на его активность. Если при присоединении к аллостерическому центру вещество увеличило активность фермента, его называют позитивным эффектором, а если снизило - негативным эффектором.
Многие ферменты содержат небелковую часть, называемую кофактором. Кофакторы делят на три группы: неорганические ионы, простетические группы (флавинадениндинуклеотид (ФАД), биотин гемм и др.) и коферменты (никотинамидадениндинуклеотид (НАД), НАДФ, АТФ и др.).
По выполняемым функциям кофакторы делят на 3 вида:
1. участвуют в переносе водорода или электронов - участвуют в окислительно-восстановительных реакциях;
2. участвуют в переносе групп атомов;
3. катализирую синтез и распад углеродных связей.
По механизму действия ферменты делят на 6 групп:
1. Оксидоредуктазы. Они катализируют окислительно-восстановительные реакции переноса атомов водорода и кислорода от одного вещества к другому (каталаза, дегидрогеназа, оксидаза и др.).
2. Трнсферазы. Катализируют перенос различных групп атомов (ацильной, метильной, фосфатной или аминогрупп) от вещества к веществу (протеинкеназа, пируваткеназы и др.).
3. Гидролазы. Катализируют реакции гидролиза, протекающие с расщеплением внутримолекулярных связей и присоединением воды в точке расщепления (амилаза, липаза, пептидаза и др.).
4. Лиазы. Катализируют реакции отщепление и присоединение групп атомов с образованием двойной связи (фумараза, альдолаза, аспартаза).
5. Изомеразы. Катализируют реакции внутримолекулярной перестройки (изомераза, глюкозоимераза и др.).
6. Лигазы. Катализируют соединение молекул с образованием новых связей с использованием связей молекул АТФ (ДНК-лигаза, синтетаза).
Ферменты синтезируются, как все белки, на рибосомах и накапливаются в цитоплазме и др. структурах, находятся на поверхности клетки, или выделяются в окружающую среду.
Дата добавления: 2014-12-27; просмотров: 3360;
