Работа №14. Водород
Предупреждение.В опытах с водородом нельзя зажигать водород, выходящий из прибора, не убедившись предварительно в его чистоте, иначе может произойти взрыв внутри прибора и разорвать его.
| Необходимые принадлежности и реактивы: металлический штатив с лапкой, спиртовка(горелка), пробка с газоотводной трубкой, пробирки, стеклянная пластинка (30.60), гранулированный цинк (или оцинкованное железо), 20%-ный раствор серной кислоты (или соляная (1:5)), порошок оксида меди (II). | |

| 1. Получение водорода действием металла на кислоту. Собрать прибор (рис. 28a). Поместить в пробирку несколько кусочков гранулированного цинка, прилить 5 мл 20% -ного раствора H2SO4 и закрыть отверстие пробирки пробкой с газоотводной трубкой, кончик которой оттянут вверху (рис. 28б). Проверить водород “на чистоту “. Для этого плавно |
| Рис.28. Получение водорода, собирание его и испытание «на чистоту» |
приподнять пробирку с водородом и держа ее вверх дном, закройте пальцем (рис.28в). Пробирку поднесите в горизонтальном положении к пламени спиртовки и откройте ее (рис. 28г). Убедившись в чистоте выделяющегося водорода (в присутствии преподавателя), можно поджечь его горящей лучинкой у отверстия газоотводной трубки. Сгорание чистого водорода сопровождается слабым хлопком. Опрокинуть над пламенем водорода холодную воронку или часовое стекло. Что наблюдается? Написать уравнение реакции получения водорода в молекулярной и ионно-электронной формах. Какие еще другие металлы и кислоты можно рекомендовать для получения водорода в лаборатории? Можно ли применять концентрированную серную кислоту для получения водорода? Ответ обоснуйте. Написать уравнение реакции горения водорода.
2. Получение водорода действием алюминия на щелочь. (Опыт проводить в вытяжном шкафу, надеть очки).
Налить в пробирку 2-3 мл 20%-ного раствора NаОН. Поместить несколько кусочков алюминиевых стружек. Закрыть пробирку пробкой со вставленной стеклянной трубкой, конец которой оттянут вверх. Если реакция идет медленно, осторожно подогреть. Проверить выделяющийся водород на чистоту. Наполнить сухую пробирку водородом и поджечь его.
Написать в молекулярном и ионно-электронном виде уравнения реакций взаимодействия алюминия со щелочью. Какие продукты при этом могут образоваться?
3. Получение водорода из воды. Железо—паровой способ получения водорода (групповой опыт).
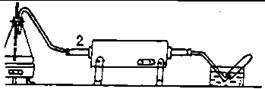
| Для получения водорода по этому способу собрать прибор по рис. 29. Включить заранее трубчатую печь. Железную или фарфоровую трубку диаметром в 2,5 см и длиной 60-70 см наполнить железными стружками. Стружки расположить ближе к середине трубки, чтобы они находились в |
| Рис.29. Установка для получения водорода железо-паровым способом. |
зоне нагревa печи. Вставить трубку в печь и закрыть плотно ее концы пробками с выходными стеклянными трубками.
Нагреть в колбе (1) воду до кипения. Когда трубка (2) с железными стружками раскалится в печи до температуры 700° (темно-красное каление), пропустить в нее водяной пар. Выделяющийся из трубки газ собрать над водой в 2—3 пробирки и испытать его горючесть. После этого отсоединить пар и выключить ток. Написать уравнения реакций. Какие продукты могут образоваться в результате реакции?Какими еще способами можно получить водород в лаборатории? Укажите достоинства и недостатки каждого из них. Написать уравнения соответствующих химических реакций.
4. Восстановление оксида меди водородом. (Опыт "столом", надеть очки!). Собрать прибор (рис.30). Проверить на герметичность. В U-образную трубку поместить безводный (предварительно прокаленный) хлорид кальция (зачем?). В расширенную часть хлоркальциевой трубки положить 0,3—0,5 г оксида меди. В колбу (емкостью 250 мл) положить 40—50 г гранулированного цинка и через воронку, опущенную почти до дна колбы, налить 100-150 мл
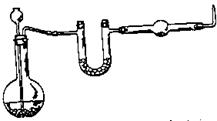
| 20%-ного раствора серной кислоты. Испытать водород на чистоту. Только после проверки водорода на чистоту можно начать нагревание прибора! Поджечь лучинкой водород у выходного отверстия прибора. Когда воздух из собранного прибора будет полностью вытеснен водородом, осторожно прогреть трубку по всей длине, а затем сильно нагреть |
| Рис. 30. Восстановление оксида меди водородом |
ту часть, где находится оксид меди. Следить за тем, чтобы пламя горящего водорода не уменьшалось. Если пламя погаснет или уменьшится, прекратить нагревание.
Когда восстановление закончится (как это установить?), прекратить нагревание и охладить прибор до комнатной температуры, продолжая пропускать водород (почему?). Не прореагировавший цинк промыть водой и сдать лаборанту. Написать уравнения реакций.
Дата добавления: 2014-12-26; просмотров: 3181;
