Работа №13. Кислород
| Необходимые принадлежности и реактивы: Спиртовка, пробирки, газометр, технохимические весы, металлический штатив с лапками, газоотводная трубка, стеклянная банка на 150-200 мл, стеклянная пластинка в качестве крышки для банки, KMnO4, KNO3, кусочки угля, порошки серы и фосфора, лучинки из дерева, щипцы, |
4.1. Получение кислорода. Газометр. Нагреть в отдельных пробирках небольшое количество перманганата или нитрата калия и доказать выделение кислорода (как?). Написать уравнения соответствующих реакций. Какими еще способами можно получить кислород в лаборатории? Указать достоинства и недостатки каждого из них? Написать уравнения соответствующих реакций.
В лаборатории, на производстве кислород часто хранят в стальных баллонах (баллоны окрашены в голубой цвет). В небольшом количестве кислород может храниться в стеклянном газометре (см. рис. 13).
Заполнение газометра кислородом. Рассчитать, какое количество KMnO4 необходимо взять для заполнения данного газометра кислородом. Отвесить рассчитанное количество KMnO4, перенести в пробирку (или реторту), закрепленную в штативе и снабженную длинной газоотводной трубкой. Нагреть пробирку с КМnО4 и, убедившись в выделении кислорода (как?), вынуть пробку из нижнего тубуса и ввести в газометр через тубус ( 1 ) конец газоотводной трубки. По мере поступления кислорода в газометр вода из него вытекает в раковину через открытый тубус (4). После наполнения газометра кислородом вынуть газоотводную трубку из тубуса, закрыть его пробкой и налить воду в воронку (3). Для отбора кислорода из газометра необходимо открыть краны (1) и (2). Вода, поступая из воронки в бутыль, вытесняет из него кислород, который выходит через трубку с краном (1). При отборе кислорода из газометра необходимо следить за тем, чтобы воронка была наполнена водой.
4.2. Определение молекулярной массы кислорода.
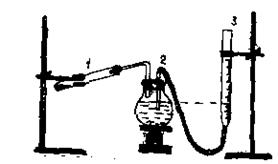
| Собрать прибор (рис. 24) и проверить его на герметичность. Взвесить сухую пробирку (1) с точностью до 0,01 г. Насыпать в пробирку немного КСlО3 (бертолетовая соль) и затем взвесить ее с такой же точностью. Навеска бертолетовой соли должна быть в пределах 0,3-0,4 г. |
| Рис.24. Определение молекулярной массы кислорода |
Добавить в пробирку в качестве катализатора немного (0,1-0,2 г) свежепрокаленной МnO2 и снова взвесить пробирку Осторожным встряхиванием перемешать содержимое пробирки. Заполнить колбу (2) через бюретку (3) (объем бюретки 100 мл), насыщенным раствором поваренной соли на 2/3 ее объема. (Почему кислород собирают над насыщенным раствором поваренной соли?)
Присоединить к колбе пробирку с КСlО3. Установить бюретку так, чтобы раствор в колбе и бюретке был на одном уровне, при этом раствор должен занимать только нижнюю часть бюретки. Записать, на каком уровне находится раствор в бюретке. Осторожно нагреть пробирку и постепенно опускать бюретку так, чтобы уровни раствора в колбе и бюретке все время совпадали. Когда уровень жидкости в бюретке перестанет изменяться, нагревание прекратить, охладить прибор до комнатной температуры и, приведя жидкость в колбе и бюретке к одному уровню, записать показания бюретки. Объем выделившегося кислорода определить по разности показаний бюретки до и после опыта. Взвесить пробирку и по разнице масс найти массу выделившегося кислорода. Записать барометрическое давление и температуру раствора поваренной соли.
Вычислить молекулярную массу кислорода по уравнению Менделеева-Клапейрона. При расчете учесть, что давление выделившегося кислорода равно разности между барометрическим давлением и упругостью водяных паров над насыщенным раствором NaCl, при температуре опыта. Определить относительную ошибку опыта.
Дата добавления: 2014-12-26; просмотров: 1608;
