ЛЕКЦИЯ 15
Безградиентный метод: Основан на принципе проведения процесса, когда в реакционном пространстве практически устранены перепады мольной доли реагирующего газа, температур и скоростей газового потока.
Аппаратурное оформление такого метода представлено системами проточно-циркуляционного типа, реакторами открытого типа, работающими в изотермическом режиме при стабильной величине мольной доли реагирующего газа и его постоянной подачи. Примером таких систем, могут служить термогравиметрические установки, работающие в условиях, обеспечивающих протекание реакций в чисто кинетическом режиме.
Благодаря экспериментально подобранным оптимальным значениям линейных (объемных) скоростей движения потока реакционного газа, омывающего чашечку с исследуемым веществом, удается полностью устранить градиенты величины мольной доли, вызываемые внешнедиффузионным торможением и продольной диффузией. Применение интенсивного перемешивания реакционной смеси позволяет свести к минимуму градиент температур как в самом слое порошкообразного вещества, так и между слоем и газовым потоком. Таким образом эти системы характеризуются практически полным отсутствием градиентов, искажающих истинные значения кинетических параметров.
Техника экспериментальных термогравиметрических исследований кинетики реакций твердое - газ:
Техника экспериментов при изучении кинетики реакций с использованием периодического взвешивания образца заключается в следующем. Навеску порошка (образец) насыпают тонким слоем на дно лодочки из материала, не реагирующего с газом (никель), которую в свою очередь помещают в реактор трубчатого типа, оборудованного электрическим нагревателем. Извлечение лодочки с навеской из реактора и ее взвешивание проводят в осушенной атмосфере, в боксе с тем чтобы исключить возможность гидролиза продуктов и полупродуктов реакции. несмотря на простоту и кажущуюся доступность, методу периодического взвешивания присущ ряд недостатков, в частности необходимость перерывов в процессе для взвешивания образца. При изучении кинетики таких реакций, как фторирование соединений урана, плутония и нептуния, промежуточные взвешивания образцов могут привести к гидролизу образовавшихся входе реакций фторидов, их разложению и образованию новых соединений – оксофторидов.

Рисунок 38. Схематическое изображение горизонтального реактора.
1. реторта реактора. 2. Лодочка. 3. Навеска порошка. 4 электрообогрев.
Необходимо учитывать тот факт, что повторное нагревание образца даже в среде инертного газа вызывает частичное разложение промежуточных фторидов из-за их термического диспропорционирования, что приводит к искажению результатов.
Недостатки, присущие методу периодического взвешивания, в значительной степени устраняются при использовании термогравиметрического метода, основанного на проведении реакции с непрерывным взвешиванием образца. Лучшими термогравиметрическими установками являются установки с широкими чашечками, что позволяет разместить на них реагирующий материал достаточно тонким слоем. В то же время необходимо учитывать то, что применение чашечки с большой площадью может вызвать продольный градиент мольной доли реагирующего газа и исказить получаемые результаты.
Итак, чтобы получить полное численное кинетическое уравнение процесса необходимо определить, в исследуемом температурном диапазоне, значения констант скорости реакции и энергию активации. Для этого: при различных температурах, в изотермических условиях, определяется степень реагирования вещества от времени.
 a, %
a, %

 Т1
Т1
Т2
 Т3
Т3

Т4
Время t
Рисунок 39. Зависимость степени реагирования от времени.
Далее, в зависимости от характера процесса данные обрабатываются по какому либо кинетическому уравнению с целью получить прямую линию на графике в координатах уравнения. По полученным данным рассчитываются значения констант скорости реакции при различных температурах .
lgt 1,0 2,0
 | |||
 | |||



 Т4 Т3 Т2 Т1
Т4 Т3 Т2 Т1


 0
0
 |  |

 -1,0
-1,0
 lgk a
lgk a
tga = n
 -2,0
-2,0
Рисунок 40. Зависимость степени реагирования от времени при различных температурах в координатах топокинетического уравнения.
Следующим шагом является получение зависимости константы скорости от температуры, график которой строится в соответствии с уравнением Аррениуса в координатах lgk – 1/T. Где tgj = - Е/R
|
| |||||
 | ||||||



 0
0
|  |


 -1,0
-1,0

-1,5
Рис.41. Зависимость константы скорости реакции от температуры.
По окончании, получив численные значения предэкспоненциального множителя и энергии активации, подставляем численные значения в кинетическое уравнение. На пример топокинетическое уравнение фторирования покрытий, полученных из порошка CaF2 с содержанием алюмофосфатной связки (200 – 6000С):
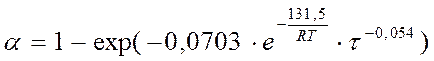 (154)
(154)
Дата добавления: 2014-12-26; просмотров: 980;
