Диффузия газа через пограничную пленку, как лимитирующая стадия процесса.
 | |||
 | |||
С
СГН


 0
0
R r 0 r R
Рисунок 17. Профиль концентрации газа вблизи поверхностного слоя частицы с учетом сопротивления пограничной газовой пленки.
1 – газовая пленка, окружающая частицу (пограничный, диффузионный слой); 2 – слой продуктов реакции (зола); 3 – уменьшенное ядро частицы.
СГН – концентрация газа снаружи; СГЗ – концентрация газа на поверхности золы; СГЯ – концентрация газа на поверхности ядра.
График показывает, что на поверхности ядра частицы газ отсутствует (СГЗ = СГЯ = 0) и следовательно концентрационная движущаяся сила СГН – СГЗ= СГН.
Таким образом концентрационная движущая сила будет неизменной в течение всего периода взаимодействия твердой частицы с газом.
Рассмотрим реакцию UO3 + H2 = UO2 + H2O. Тогда уравнение скорости реакции:
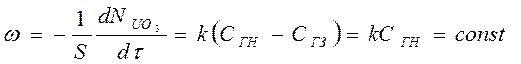 (70)
(70)
где S – площадь поверхности, при условии, что она постоянна. dNUO3 = dNH2 . Количество UO3 можно представить как произведение объема ядра VUO3 на молярно объемную плотность rUO3 , что по сути является молярной концентрацией UO3 в кмоль/м3: NUO3 = VUO3 × rUO3 . Так как твердая частица имеет сферическую форму, то VUO3 = 4/3 ×pr3. Уменьшение объема или радиуса невзаимодействующего ядра эквивалентно исчезновению из зоны реакции dNUO3 молей, тогда:
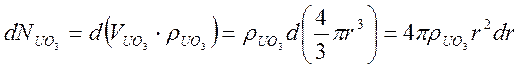 (71)
(71)
Поверхность S, к отрой отнесена скорость внешней диффузии, это внешняя поверхность твердой частицы с радиусом R:
 (72)
(72)
Подставляя dNUO3 из уравнения (71) в уравнение (72), получим
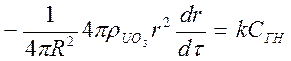 (73)
(73)
Решим дифференциальное уравнение (73):
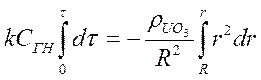 (74)
(74) 
 ,
,  (75)
(75)
Отношение (r/R)3 можно заменить на отношение объема непрореагировавшего ядра к объему всей твердой частицы (VUO3/V0 = (r/R)3) и умножив числитель и знаменатель на × rUO3 получим:
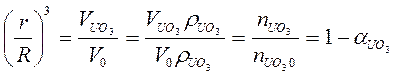 (76)
(76)
где V0 – полный объем твердой частицы неменяющихся размеров.
Преобразуем уравнение (75):
 (77)
(77)
Обозначим время, за которое частица полностью прореагирует, через tП, при этом r = 0. При aUO3 = 1 (весь UO3 прореагировал) уравнение (77) позволяет определить время полного превращения твердой частицы:
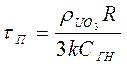 (78)
(78)
Следовательно, для внешнедиффузионной области протекания гетерогенной реакции зависимость между t и aUO3 имеет линейный характер:




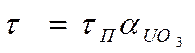 (79)
(79)
a 


t/tП
Рисунок 18. Графическая зависимость степень реагирования от t/tП.
1- скорость процесса лимитируется диффузией через пограничный слой.
3 – скорость процесса лимитируется диффузией газа через слой продуктов реакции (золы). 2 – промежуточный случай.
Дата добавления: 2014-12-26; просмотров: 1318;
