Реакции окисления
Благодаря легкости разрыва p-связи олефины хорошо окисляются. Различаются следующие виды реакций окисления:
1.С разрывом только p-связи.
а) окисление по Вагнеру – действие разбавленного водного раствора KMnO4 при комнатной температуре – приводит к образованию гликолей
СH2=CH2 + O 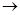 CH2-CH2 + HOH
CH2-CH2 + HOH 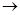 CH2-CH2
CH2-CH2
(KMnO4) O OH OH
+H2O
окись этилена этиленгликоль
б) окисление надкислотами (реакция Прилежаева) приводит к образованию окисей.
O
СH2=CH2 + C6H5-C-O-OH 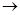 CH2-CH2 + C6H5C
CH2-CH2 + C6H5C
O O OH
надбензойная кислота бензойная кислота
2.Окисление с разрывом углеродной цепи происходит при действии сильных окислителей и при нагревании, например:
KMnO4 + H2SO4; продуктами реакций могут быть кетоны и карбоновые кислоты
O O
CH3-C=CH-CH3 + 3O 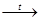 CH3-C + CH3-C
CH3-C + CH3-C
CH3 CH3 OH
2-метил-2-бутен
3.Озонирование – окисление озоном О3.
При действии озона сначала происходит его присоединение по двойной связи с образованием озонидов.
O-O-O O – O CH3
СH2=C-CH3 + O3 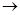 CH2-C-CH3
CH2-C-CH3 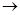 CH2 C
CH2 C
CH3 CH3 O CH3
Озониды разлагаются водой, давая альдегиды и кетоны, в зависимости от наличия заместителей
O-O-O O O
CH2-C-CH3 + H2O 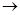 H2O2 + CH2 + C-CH3
H2O2 + CH2 + C-CH3
CH3 CH3
По строению образующихся соединений можно легко установить местоположение двойной связи в олефине.
Дата добавления: 2014-12-24; просмотров: 1173;
