Основные химические понятия
Химический элемент – вид атомов, характеризующихся одинаковым зарядом ядра.
Атом– наименьшая частица элемента, обладающая его химическими свойствами и неделимая при химических реакциях.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Простое вещество – вещество, в состав которого входят атомы одного и того же элемента.
Сложное вещество – вещество, в состав которого входят атомы разных элементов.
Атомная единица массы (а. е. м.) – 1/12 массы атома углерода – 12(12с), т.е. 1,6666∙10-27 кг.
Относительная атомная масса элемента (Аr) – безразмерная величина, равная отношению средней массы атома естественного изотопического состава элемента и 1/12 массы углерода-12:
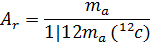
(подстрочная буква r – от лат. relativus относительный).
Относительная молекулярная масса (Mr) простого или сложного вещества – безразмерная величина, равная отношению средней массы естественного изотопического состава вещества к 1/12 массы атома углерода – 12.
Условная частица (УЧ) – любой вид реальных частиц (атомы, молекулы, ионы, электроны, атомные группы и т. д.) и условно существующие доли таких частиц (1/2 Ba2+ , 1/3 H3PO4 и т. п.).
Моль– единица количества вещества или системы, содержащая столько определенных УЧ, сколько атомов содержится в углероде – 12 массой 0,012 кг, т. е. 6,02∙1023.
Постоянная Авогадро Na равна отношению числа частиц любой системы (N) к количеству вещества системы n: N/n=NAмоль-1=6,02∙1023 моль-1.
Молярная масса M(X) вещества, состоящего из частиц X, равна отношению m порции вещества к количеству вещества n(X) в этой порции:
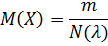
Единица молярной массы – кг∙моль-1 или г∙моль-1
Числовое значение молярной массы {M}; выраженной в г/моль, равно относительной молекулярной массе. Например, Ar(Na)= 23 и Mr(H2SO4)=98, следовательно, M(Na)=23 г/моль, а M(H2SO4)=98 г/моль.
Молярный объем Vm – отношение объема вещества к количеству вещества в этом объеме:
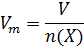
Единица измерения – м3/моль или л/моль.
При n(X)= 1 моль Vm = 22.4л или 22,4∙10-3 м3.
Масса атома (кг, г) – отношение молярной массы элемента к постоянной Авогадро. Так,
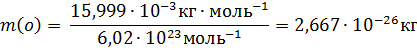
Масса атома равна также произведению относительной атомной массы на атомную единицу массы. Тогда m(0)=15,999∙1,6605∙10-27кг = 2,667∙10-26кг.
Масса молекулы (кг, г) – отношение молярной массы данного вещества к постоянной Авогадро. Так,


Дата добавления: 2014-12-24; просмотров: 945;
