Ионная модель химической связи. Поляризация ионов.
 Модель ионной химической связи основана на рассмотрении простых или сложных ионов в качестве химических структурных элементов вещества, кулоновское взаимодействие между которыми приводит к образованию химических соединений в результате понижения энергии системы. Поскольку электрическое поле ионов является сферически симметричным, то ионная химическая связь не обладает ни направленностью в пространстве, ни насыщаемостью. В результате этого соединения с ионным характером химической связи характеризуются как высокими координационными числами, так и высокой степенью упорядоченности в пространстве. Так, взаимодействие ионов Na+ и Cl- приводит к образованию кристаллической структуры, в которой каждый из ионов окружен шестью противоионами. При этом все связи данного иона с соседями эквивалентны и кристалл можно рассматривать как единую молекулу (NaCl)n. Ионные молекулы NaCl можно обнаружить только в парах при высоких температурах (t > 1000 oC) причем, и в паре кроме молекул NaCl присутствуют также различные ассоциаты (NaCl)2, (NaCl)3 и ионы [Na2Cl]+, [NaCl2]-.
Модель ионной химической связи основана на рассмотрении простых или сложных ионов в качестве химических структурных элементов вещества, кулоновское взаимодействие между которыми приводит к образованию химических соединений в результате понижения энергии системы. Поскольку электрическое поле ионов является сферически симметричным, то ионная химическая связь не обладает ни направленностью в пространстве, ни насыщаемостью. В результате этого соединения с ионным характером химической связи характеризуются как высокими координационными числами, так и высокой степенью упорядоченности в пространстве. Так, взаимодействие ионов Na+ и Cl- приводит к образованию кристаллической структуры, в которой каждый из ионов окружен шестью противоионами. При этом все связи данного иона с соседями эквивалентны и кристалл можно рассматривать как единую молекулу (NaCl)n. Ионные молекулы NaCl можно обнаружить только в парах при высоких температурах (t > 1000 oC) причем, и в паре кроме молекул NaCl присутствуют также различные ассоциаты (NaCl)2, (NaCl)3 и ионы [Na2Cl]+, [NaCl2]-.
Строение ионных химических соединений и величина координационного числа в значительной степени определяется радиусами и зарядами ионов - наиболее устойчивы структуры, соответствующие максимальной энергии притяжения противоположно заряженных ионов и минимальной энергии отталкивания ионов одного заряда. Так, наиболее устойчивыми структурами для координационного числа 2, 3, 4, 6 и 8 являются соответственно линейная, плоская треугольная, тетраэдрическая, октаэдрическая и кубическая. Величина координационного числа (КЧ) зависит от относительных размеров (r+/r-) центрального положительно заряженного иона и отрицательно заряженных ионов лигандов - c ростом величины (r+/r-) КЧ увеличивается:
| КЧ | Структура | Отношение радиусов |
| Кубическая | r+/r- > 0.732 | |
| Октаэдрическая | 0.732 > r+/r- > 0.414 | |
| Тетраэдрическая | 0.414 > r+/r- > 0.225 | |
| Плоская треугольная | r+/r- > 0.155 |
Пример 1. На основании величин ионных радиусов (по Полингу):
| Ион | Na+ | Cs+ | Sr2+ | Pb4+ | F- | Br- | O2- |
| R, нм | 0.095 | 0.169 | 0.113 | 0.084 | 0.136 | 0.195 | 0.140 |
определить значение координационного числа катиона и аниона, а также структуру кристаллической решетки следующих соединений: а) NaBr, б) CsBr, в) CaF2, г) PbO2.
Решение. a). Отношения радиусов r(Na+)/r(Br-) = 0.487 соответствует КЧ = 6 с октаэдрическим окружением катионов Na+ анионами Br- в кристаллической решетке NaBr. Поскольку катион и анион имеют одинаковый заряд, то анионы Br- также имеют октаэдрическое окружение из ионов Na+, соответствующее КЧ = 6. Таким образом, кристаллическая решетка NaBr характеризуется октаэдрическим окружением как катионов, так и анионов, что соответствует кристаллической решетке типа “каменной соли NaCl”;
б). Отношение радиусов r(Cs+)/r(Br-) = 0.867 соответствует КЧ = 8 с кубическим окружением катионов Cs+ анионами Br- и анионов Br- катионами Cs+ в кристаллической решетке CsBr. Такие кристаллические решетки соответствуют решеткам типа «хлорида цезия».
в). Отношение радиусов r(Sr2+)/r(F-) = 0.83 также соответствует КЧ = 8 с кубическим окружением катионов Sr2+ анионами F- в кристаллической решетке SrF2. Однако, поскольку заряд аниона F- в два раза меньше заряда катиона, то координационное число анионов в кристаллическое решетке SrF2 равно 4, что соответствует их тетраэдрическому окружению ионами Sr2+. Следовательно, SrF2 характеризуется кристаллической решеткой с кубическим окружением катионов и тетраэдрическим окружением анионов, что соответствует кристаллической решетке типа “флюорита CaF2”;
г). Отношение радиусов r(Pb4+)/r(O2-) = 0.6 соответствует КЧ = 6 с октаэдрическим окружением катионов Pb4+ анионами O2- и поскольку заряд анионов в два раза меньше заряда катионов, то КЧ анионов равно 3, что соответствует тригональному окружению ионов О2- катионами Pb4+. Таким образом, PbO2 характеризуется кристаллической решеткой с октаэдрическим окружением катионов и тригональным окружением анионов, что соответствует кристаллической решетке типа «рутила TiO2».
Энергия процессов гетеролитического Az+Bz- = Az+ + Bz- (Е) и гомолитического Az+Bz- = A + B (ЕАВ) разрыва химической связи в ионных молекулах определяются уравнениями[*]:
Е = [(ze)2/r0][1-(1/n)],
ЕАВ = [(ze)2/r0][1-(1/n)] + I – Ae,
где r0 – длина химической связи между ионами; n – коэффициент борновского отталкивания ионов, величина которого для ионов с благородногазовой электронной структурой He, Ne, Ar, Kr и Xe составляет соответственно 5, 7, 9, 10 и 12; I – энергия ионизации атома А; Ae – энергия сродства к электрону атома В. Величина EAB соответствует энергии химической связи молекулы АВ.
Пример 2. Определить величину энергии процессов гетеролитического и гомолитического разрыва связи в молекуле KCl, если длина химической связи равна 0.267 нм, потенциал ионизации калия 4.34 эВ и энергия сродства к электрону хлора 3.61 эВ.
Решение. Поскольку ионы K+ и Cl- являются изоэлектронными ионами с электронной оболочкой Ar, то значение борновского коэффициента отталкивания для этих ионов в молекуле NaCl равно 9 и энергии процессов гетеролитического и гомолитического разрыва связи в молекуле NaCl составляют:
E = [(4.8×10-10)2/2.67×10-8][1-1/9] = 7.664×10-12 эрг = 4.79 эВ,
EKCl = E + I – Ae = 4.79 + 3.61 – 4.34 = 4.06 эВ.
При переходе от молекулы к кристаллу энергетическое состояние ионов изменяется – каждый ион взаимодействует не с одним ионом противоположного знака, а с большим количеством ионов как противоположного, так и одинакового заряда, находящихся на различных расстояниях от рассматриваемого иона. Например, в кристаллической решетке NaCl, характеризующейся октаэдрическим окружением противоионами как Na+, так и Cl-, каждый ион Na+ взаимодействует - с 6 ближайшими ионами Cl-, находящимися на расстоянии r0, с 12 ионами Na+ на расстоянии r0 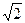 , с 8 ионами Cl- на расстоянии r0
, с 8 ионами Cl- на расстоянии r0 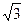 и т.д. Для учета этого дополнительного электростатического взаимодействия в выражение для энергии ионной кристаллической решетки – энергия образования 1 моль кристаллического вещества из свободных газообразных ионов – по сравнению с энергией гетеролитического разрыва связи ионной молекулы входит, наряду с числом Авагадро NA , коэффициент Моделунга a:
и т.д. Для учета этого дополнительного электростатического взаимодействия в выражение для энергии ионной кристаллической решетки – энергия образования 1 моль кристаллического вещества из свободных газообразных ионов – по сравнению с энергией гетеролитического разрыва связи ионной молекулы входит, наряду с числом Авагадро NA , коэффициент Моделунга a:
Екр.р. = аNA(ze)2/r0][1-(1/n)].
Величина коэффициента Моделунга зависит от типа ионной кристаллической решетки химического соединения:
| Тип решетки | Формула | КЧ | Коэффициент Моделунга | |
| Катиона | Аниона | |||
| Хлорид цезия | CsCl | 1.76 | ||
| Каменная соль | NaCl | 1.75 | ||
| Вюртцит | ZnS | 1.64 | ||
| Рутил | TiO2 | 2.41 | ||
| Флюорит | CaF2 | 2.52 |
Коэффициенты Моделунга превышают единицу, что указывает на значительные энергетические затраты при переходе химических соединений с преимущественно ионной химической связью из кристаллического состояния в жидкое или газообразное, состоящие из молекул или их ассоциатов. В связи с этим, ионные кристаллы имеют высокие температуры плавления и большие теплоты сублимации.
Пример 3. Определить энергию кристаллической решетки RbCl, если ионные радиусы рубидия и хлора составляют 0.147 нм и 0.181 нм.
Решение. Отношение ионных радиусов r(Rb+)/r(Cl-) = 0.81 указывает на КЧ 8 для катионов рубидия и анионов хлора и на структурный тип кристаллической решетки RbCl – типа хлорида цезия, что определяет значение коэффициента Моделунга a = 1.76.
Поскольку ион Rb+ имеет электронную структуру Kr (n = 10), а ион Cl- - электронную конфигурацию Ar (n = 9), то среднее значение борновского коэффициента отталкивания для этих ионов равно 9.5.
В качестве оценки длины химической связи между ионами Rb+ и Cl- может быть использована сумма их ионных радиусов:
r0 = r(Rb+) + r(Cl-) = 0.147 + 0.181 = 0.328 нм
Таким образом, величина энергии кристаллической решетки RbCl:
Eкр.р.= 1.76×6.023×1023[(4.8×10-10)2/3.28×10-8][1-1/9.5] = 6.62×1012 эрг/моль = 662 кДж/моль.
Поскольку образование химической связи обязательно сопровождается изменением в электронном строении взаимодействующих химических структурных элементов вещества (атомов или ионов), связанным с определенной степенью обобществления электронов в межъядерном пространстве, то химических соединений со 100% ионной связью не существует. Для учета изменения в электронном строении взаимодействующих ионов в ионной модели используются представления о взаимной поляризации ионов - относительном смещении ядра и окружающих его внешних электронов под действием электрического поля противоиона. Такая деформация электронной оболочки ионов ведет к снижению степени ионности связи и увеличению степени ее ковалентности.
Процесс поляризации является двухсторонним – в нем сочетаются поляризуемость ионов с их поляризующим действием. Поляризуемость ионов определяется их способностью к деформации под действием внешнего электрического поля, тогда как поляризующее действие - способностью иона поляризовать (деформировать) противоион. Как поляризуемость, так и поляризующее действие ионов зависят от радиуса, заряда и электронной структуры иона. При одинаковой электронной структуре с ростом ионного радиуса и величины отрицательного заряда (уменьшении положительного заряда) поляризуемость ионов увеличивается, а поляризующее действие уменьшается. Поэтому при взаимодействии ионов с одинаковой благородногазовой электронной структурой поляризации в основном подвергается анион; катион же в основном оказывает только поляризующее действие и поляризации практически не подвергается.
Пример 4. Как и почему изменяется поляризующее действие и поляризуемость ионов в ряду: a) галогенидных анионов и катионов щелочных металлов; б) O2-, F-, Na+, Mg2+, Al3+?
Решение. а) галогенидные анионы Hal- и катионы щелочных металлов характеризуются подобной ns2np6 благородногазовой электронной структурой, одинаковым зарядом, но разным ионным радиусом. Увеличение радиуса ионов по группе с ростом главного квантового числа валентных орбиталей определяет увеличение поляризуемости анионов: F- < Cl- < Br- < I- < At- и уменьшение поляризующего действия катионов: Li+ > Na+ > K+ > Rb+ > Cs+ > Fr+;
б) уменьшение радиуса, увеличение положительного и уменьшение отрицательного заряда изоэлектронных 2s22p6 ионов O2-, F-, Na+, Mg2+, Al3+ приводит к уменьшению в этом ряду поляризуемости и увеличению поляризующего действия ионов.
В зависимости от электронного строения как поляризующее действие, так и поляризуемость ионов с ростом числа электронов на внешней оболочке увеличивается. Так, несмотря на большее значение ионного радиуса Pb2+ (0.120 нм) по сравнению с радиусом Sr2+ (0.112 нм), поляризующее действие катиона Pb2+ 5s25p65d106s2 с 18+2 электронами на внешних орбиталях больше поляризующего действия Sr2+ 4s24p6 с 8 электронным строением внешнего уровня. Особенно, велика роль электронного строения внешних орбиталей в увеличении эффективного поляризующего действия катионов d-элементов в результате явления самополяризации – катион оказывает поляризующее действие на противоион, приводя к его деформации и, благодаря деформируемости частично заполненной электронами d-оболочки, сам поляризуется, что приводит к усилению эффективного поляризующего действия катиона. Поскольку эффективность процесса самополяризации катионов увеличивается с ростом орбитального радиуса d-орбиталей и увеличением их заселенности электронами, то наиболее важную роль явление самополяризации играет в характере изменения поляризующего действия катионов поздних d-элементов.
Пример 5. Как и почему изменяется поляризующее действие катионов: а) V3+, Nb3+, Ta3+; б) Cu+, Ag+, Au+?
Решение. а) ионы V3+, Nb3+, Ta3+ относятся к катионам ранних d-элементов 5 группы с подобной (n-1)d2 электронной структурой и одинаковым зарядом. В связи с этим, изменение в поляризующем действии катионов определяется характером изменения их ионного радиуса. Поскольку r(V3+) > r(Nb3+) » r(Ta3+), то поляризующее действие катионов: V3+ > Nb3+ » Ta3+;
б) ионы Cu+, Ag+, Au+ относятся к катионам поздних d-элементов 1 группы с подобной (n-1)d10 электронной структурой и одинаковым зарядом. Основную роль в характере изменения поляризующего действия таких катионов играет явление самополяризации. Поскольку деформируемость валентных d-орбиталей с ростом главного квантового числа увеличивается, то поляризующее действие катионов по группе также увеличивается: Cu+ > Ag+ > Au+.
Введение поляризационных представлений в ионную модель химической связи позволяет качественно рассмотреть характер изменения степени ионности и ковалентности химических связей в ряду однотипных соединений и, как следствие этого, характер изменения их некоторых физико-химических свойств, зависящих от эффективности процессов гомолитического или гетеролитического разрыва химической связи. Процессам, связанным с гетеролитическим разрывом связи способствует ее ионность, а процессам с гомолитическим разрывом связи – ее ковалентность.
Пример 5. Как и почему изменяются кислотно-основные свойства, термическая устойчивость и окислительные свойства в ряду: HClO, HBrO, HIO?
Решение. Ионная модель рассматривает свойства кислородсодержащих кислот HHalO с точки зрения свойств гидроксидов [Hal]+[ОН]-, образованных в результате взаимодействия катионов Hal+ и анионов ОН-. Свойства гидроксидов Hal(ОН) определяются характером химических связей Hal-ОН и HalО-Н. В результате поляризующего действия катиона Hal+ происходит деформация гидроксид ионов, характеризующаяся смещением электронной плотности как от атома кислорода гидроксид-иона к катиону [Hal]d+[OH]d-, так и от атома водорода к атому кислорода в самом деформируемом анионе [Hal]d+ [OD-HD+]d-. Таким образом, эффект поляризации ионов в гидроксидах Hal(ОН) определяет с одной стороны уменьшение ионности и появление некоторой степени ковалентности связи Ha-ОН, а с другой – уменьшение ковалентности и увеличение ионности связи HalО-Н в деформируемом анионе. С ростом поляризующего действия Hal+ эти изменения в характере химических связей увеличиваются.
Кислотно-основные свойства гидроксидов Hal(ОН) определяются возможностью протекания в водных растворах двух конкурирующих процессов гетеролитического разрыва связей Hal-ОН и HalО-Н, приводящих к электролитической диссоциации по основному или кислотному типу:
ЭО- + Н+(Н3О+) Û Э(ОН) Û Э+ + ОН-
Процессу диссоциации по основному типу способствует увеличение ионности связи Hal-ОН, тогда как процессу диссоциации по кислотному типу – увеличение ионности связи HalО-Н. С ростом главного квантового числа валентных орбиталей величина ионного радиуса катионов Hal+ по группе галогенов увеличивается, а поляризующее действие катионов уменьшается: Cl+ > Br+ > I+. Это приводит к последовательному уменьшению по группе от хлора к иоду кислотных и увеличению основных свойств галогеноватистых кислот.
Термическая устойчивость гидроксидов определяется процессом гомолитического разрыва связи Hal-ОН:
HalОН ® Hal + ОН,
которому способствует ковалентность связи Hal-ОН. Поскольку с уменьшением поляризующего действия катиона по группе: Cl+ > Br+ > I+ ковалентность связи Hal-OH уменьшается, то термическая устойчивость соединений увеличивается: HClO < HBrO < HIO.
Первичными продуктами термического разложения галогеноватистых кислот в результате гомолитического разрыва связи Hal-OH являются высокореакционные радикалы – атомарные галогены и гидроксильные радикалы – характеризующиеся окислительными свойствами. Поскольку термическая устойчивость в ряду HClO < HBrO < HIO увеличивается, а окислительные свойства атомарных галогенов с уменьшением энергии сродства к электрону от хлора к иоду уменьшаются, то окислительные свойства в ряду галогеноватистых кислот HClO > HBrO > HIO уменьшаются.
Пример 6. Почему хлорид меди(I) имеет более низкую температуру плавления (430 oC) по сравнению с хлоридом натрия (801 оС), хотя радиусы ионов Cu+ и Na+ одинаковы?
Решение. Несмотря на одинаковый заряд и радиус, ионы Cu+ и Na+ имеют различную электронную структуру. В отличие от Na+ 2s22p6 с 8 электронным благородногазовым строением, ион Cu+ 3d103s23p6 относится к катионам поздних d-элементов с повышенным в результате явления самополяризации поляризующим действием. Более сильное поляризующее действие катионов Cu+ по сравнению с Na+ приводит к большему уменьшению величины эффективных зарядов ионов в кристалле CuCl, чем NаCl и, как следствие этого, к уменьшению энергии кристаллической решетки. Пониженная величина энергии кристаллической решетки CuCl по сравнению с NaCl определяет различие в температурах плавления кристаллов Tпл.(CuCl) < Tпл.(NaCl).
Пример 7. Как и почему изменяется растворимость в водных растворах галогенидов серебра? Сравнить растворимость AgCl и KCl, если значения ионных радиусов Ag+ и K+ составляют 0.126 и 0.133 нм.
Решение. В ряду галогенидов серебра AgHal изменяется природа анионов, характеризующихся поляризуемостью. По группе с увеличением главного квантового числа валентных орбиталей величина ионного радиуса от фтора к иоду увеличивается, что приводит к увеличению поляризуемости анионов и уменьшению степени ионности связи Ag-Hal. Поскольку растворимость солей в полярным водном растворителе с уменьшением степени ионности связи между катионом и анионом уменьшается, то растворимость в ряду галогенидов серебра от фтора к иоду также уменьшается: AgF > AgCl > AgBr > AgI.
Значительное уменьшение растворимости AgCl по сравнению с KCl в полярном водном растворителе связано с уменьшением степени ионности связи между катионом и анионом в результате повышенного поляризующего действия катиона Ag+ 18 электронной 4d104s24p6 структурой внешней оболочки по сравнению с катионом K+ c 8 электронной 3s23p6 благородногазовой оболочкой.
Пример 8. Как и почему изменяется устойчивость хлоридных комплексов в водных растворах в ряду: а) [ZnCl4]2-, [CdCl4]2-, [HgCl4]2-; б) [TiCl6]2-, [ZrCl6]2-, [HfCl6]2-?
Решение. Устойчивость коплексных ионов в водных растворах определяется эффективностью протекания процесса их диссоциации с образованием в растворе ионов лигандов и центрального иона комплексообразователя:
[MCln]2-Û Mz+ + nCl-.
Эффективность такого процесса тем выше, чем больше ионности связи между катионом центрального иона комплексообразователя и анионами лигандов.
а) в ряду [ZnCl4]2-, [CdCl4]2-, [HgCl4]2- в качестве центральных ионов комплексообразователей выступают катионы поздних d-элементов II группы с nd10ns2np6 электронной структурой, для которых поляризующее действие по группе от цинка к ртути увеличивается в результате роста эффекта самополяризации катионов с ростом главного квантового числа валентных d-орбиталей. Увеличение поляризующего действия в ряду Zn2+ < Cd2+ < Hg2+ определяет уменьшение степени ионности связи катионов с анионами лигандов в комплексных ионах, что приводит к закономерному увеличению устойчивости комплексов в ряду [ZnCl4]2- <[CdCl4]2- <[HgCl4]2-;
б) в ряду [TiCl6]2-, [ZrCl6]2-, [HfCl6]2- в качестве центральных ионов комплексообразователей выступают катионы ранних d-элементов IV группы, для которых изменение поляризующего действия по группе Ti4+ > Zr4+ » Hf4+ определяется изменением величины ионного радиуса: r(Ti4+) < r(Zr4+) » r(Hf4+). В соответствии с характером изменения поляризующего действия катионов изменяется степень ионности связи катиона металла с лигандами и устойчивость комплексных ионов к процессу диссоциации [TiCl6]2- > [ZrCl6]2- » [HfCl6]2-.
Пример 9. Как и почему изменяется термическая устойчивость карбонатов в ряду: Li2CO3, Rb2CO3, H2CO3?
Решение. Термическое разложение карбонатов с образованием углекислого газа и оксидов:
Э2СО3 = Э2О + СО2
определяется эффективностью процесса гомолитического разрыва связи Э-О, которая зависит от степени коволентности связи катионов с карбонатным анионом. С ростом поляризующего действия катиона степень ковалентности связи Э-О увеличивается и термическая устойчивость карбонатов уменьшается.
Специфика электронного строения атома H 1s1 определяет уникальные свойства его катионаН+, характеризующегося аномально малым радиусом и отсутствием электронов. В рамках ионной модели это приводит к аномально высокому поляризующему действию катионов H+ и образование им преимущественно ковалентных химических связей, что определяет низкую термическую устойчивость кислородсодержащих кислот. Значительное увеличение радиуса катиона при переходе от угольной кислоты к солям Li2CO3 и Rb2CO3 приводит к существенному уменьшению поляризующего действия катионов H+>>Li+>Rb+ и увеличению термической устойчивости карбонатов: Rb2CO3>Li2CO3>>H2CO3.
Пример 10. Обосновать изменение формы существования катионов Cr2+, Cr3+ и Cr6+ в нейтральных водных растворах.
Решение. Форма существования катионов в водных растворах в виде аква-, аквагидроксо-, гидроксо- и оксокомплексов:
[Эz+(H2O)n]z+ Û [Эz+(H2O)n-z(ОН)z] + zH+
[Эz+(H2O)n-z(ОН)z] Û [Эz+(ОН)n](z-n)- + (n-z)H+
[Эz+(ОН)n](z-n)- Û [Эz+Оm](z-2m)- + kH+
определяется эффективностью протекания процессов диссоциации координированной воды в результате поляризующего действия катиона. Чем выше поляризующее действие катиона, тем эффективность диссоциации координированной воды больше, что приводит к изменению формы существования катионов от аквакомплексов к аквагидроксо-, гидроксо- и оксокомплексов.
В ряду катионов Cr2+, Cr3+ и Cr6+ с ростом заряда и уменьшением радиуса поляризующее действие увеличивается: Cr2+ < Cr3+ << Cr6+, что и приводит к различной форме существования их в водных растворах: [Cr(H2O)6]2+, [Cr(H2O)3(OH)3], [CrO4]2-.
 Упражнения:
Упражнения:
62. Используя значения ионных радиусов (по шкале Полинга): r(Na+) = 0.095 нм, r(Cs+) = 0.169 нм, r(Th4+) = 0.105 нм, r(Sn4+) = 0.071 нм, r(I-) = 0.216 нм, r(O2-) = 0.14 нм, определить координационные числа катиона и аниона, а также структуру кристаллической решетки следующих соединений: а) NaI, б) CsI, в) ThO2, г) SnO2.
63. Определить величину энергии процессов гетеролитического и гомолитического разрыва связи в молекуле NaBr, если величина ионных радиусов натрия и брома составляют 0.095 нм и 0.195 нм, потенциал ионизации натрия 5.14 эВ и энергия сродства к электрону брома 3.36 эВ.
64. Определить энергию кристаллической решетки NaI, если ионные радиусы натрия и иода составляют 0.095 нм и 0.216 нм.
65. Как и почему изменяется поляризующее действие и поляризуемость ионов в ряду: a) халькогенидных анионов и катионов щелочноземельных металлов; б) S2-, Cl-, K+, Ca2+; в) Ti2+, Zr2+, Hf2+; г) Ni2+, Pd2+, Pt2+?
66. Как и почему изменяются кислотно-основные свойства и термическая устойчивость в ряду гидроксидов непереходных и переходных элементов II группы?
67. Почему, несмотря на одинаковые значения радиусов r(Tl+) = r(Rb+) = 0.147 нм и зарядов катионов, RbF имеет более высокую температуру плавления 780 оС по сравнению с TlF – 327 oC?
68. Почему растворимость в водных растворах хлорида золота(I) значительно меньше, чем хлорида калия, хотя значения ионных радиусов катионов K+(0.133 нм) и Au+(0.135 нм) близки?
69. Обосновать изменение формы существования катионов Mn2+ и Mn6+ в нейтральных водных растворах.
70. Как и почему изменяется форма существования катионов Al3+ в кислом, нейтральном и щелочном водном растворе?
71. Как и почему изменяется устойчивость комплексных ионов: а) [HgF4]2-, [HgCl4]2-, [HgBr4]2-, [HgI4]2-; б) [FeCl6]3-, [FeCl6]4-?
72. Объяснить различный характер продуктов реакции взаимодействия водных растворов нитратов цинка и ртути(II) со щелочами.
73. Как и почему изменяется термическая устойчивость в ряду галогенидов золота(III)?
74. Обосновать характер изменения термической устойчивости в ряду: AgClO4, NaClO4, HClO4.
Дата добавления: 2014-12-20; просмотров: 3132;
