Зависимость физических свойств органических соединений от строения
Выполняется следующая общая закономерность: температура кипения и плавления органического соединения тем выше, чем больше его молекулярная масса, меньше степень разветвлённости молекулы и чем больше межмолекулярных связей (и чем они прочнее). Различают силы трех типов: силы Ван-дер-Ваальса (действуют между любыми молекулами, независимо от строения и наличия функциональных групп), межмолекулярных сил, возникающих за счет общей полярности молекулы (отсутствуют в углеводородах, возникают только у органических соединений, содержащих функциональные группы), и водородной связи (возникает между карбоксильными и гидроксильными группами). Температуры плавления по сравнению с температурами кипения больше зависят от формы молекулы (плотность упаковки в кристаллах).
В углеводородах связи С–Н и С–С не полярны, и силы сцепления определяются силами Ван-дер-Ваальса, которые больше для более длинных цепей, т.к. с увеличением длины цепи возрастает число мест в молекуле, способных проявлять взаимное притяжение. Увеличение разветвленности увеличивает степень приближения к сферической симметрии для молекулы, что снижает возможность межмолекулярных контактов. Так, температуры кипения следующих изомеров: пентана, 2-метилбутана и диметилпропана снижаются в этом ряду.
В целом цис-формы геометрически изомерных алкенов имеют более низкие температуры плавления, чем транс-формы из-за большей симметрии последних. Так, цис- и транс-2-бутены плавятся при –139 и –106 °С.
Введение заместителей приводит к замещенному соединению, имеющему более высокие температуры кипения и плавления, чем углеводороды сравнимого молекулярного веса. Наличие заместителя вызывает появление сильных сил притяжения за счёт поляризации связей; ещё больше увеличивают межмолекулярное притяжение водородные связи (самые сильные между карбоксильными группами). Например, пентаналь, 1-пентанол и бутановая кислота имеют приблизительно одинаковые молекулярные массы (86 и 88 г/моль), а их температуры кипения сильно отличаются: 103, 138 и 164 °С соответственно.
Электронные эффекты (индуктивный и мезомерный)
Поляризация молекулы обусловлена различным влиянием атомов, входящих в состав молекулы. Атомы с большой электроотрицательностью притягивают к себе электроны s-связей. Такой вид поляризации (сдвиг электронной плотности s-связи под действием разности в электроотрицательности связанных атомов) называется индуктивным эффектом (обозначается заглавной латинской буквой I и прямой стрелкой (®)). Если в связи С-Х электронная плотность сдвинута в сторону заместителя Х по сравнению со связью С-Н, то такое влияние заместителя называют отрицательным индуктивным эффектом (-I). Если же смещение происходит в сторону атома С по сравнению со связью С-Н, то такое действие заместителя называют положительным индуктивным эффектом (+I). При передаче по цепи индуктивный эффект затухает.

 Н Н
Н Н

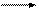
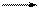 Н Сd+2 Сd+1 Сld- d+2 < d+1
Н Сd+2 Сd+1 Сld- d+2 < d+1
Н Н
+I- Эффектом характеризуются алкильные радикалы, -I эффектом– атомы галогенов, функциональные группы, содержащие кислород, азот, серу, кратные связи, а также группы, несущие положительный заряд.
Если в молекуле имеются системы сопряженных простых и кратных связей или атомы с неподеленными электронными парами, включенными в систему сопряжения, они могут участвовать в образовании общего p-электронного облака. Участие групп в сопряжении и влияние их на состояние p-электронного облака молекулы называют мезомерным эффектом (сдвиг электронной плотности сопряжённых p-связей) , или эффектом сопряжения (обычно обозначается заглавной буквой М; реже – заглавной буквой С). Для его обозначения используется изогнутая стрелка. У атомов азота, кислорода, фтора внешняя электронная оболочка заполнена, и они способны смещать p-электроны неподеленной электронной пары в сторону бензольного ядра или ненасыщенного углеродного атома:
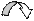 | |||
 |
СН3 - О - СН = Сd-Н2
Если в систему сопряжения входит кратная связь между разнородными атомами, то общее p-электронное облако смещается в сторону более электроотрицательного атома:
 Od-
Od-
СН2 = СН-Cd+
Н
Положительный мезомерный эффект проявляют группы: –ОН; –OR; –NH2; -NR2; –SH; галогены (смещение электронной плотности от гетероатома); отрицательный: группы -NO2, -CºN, -СООН, -SО3Н (смещение электронной плотности к гетероатому функциональной группы). Наличие индуктивного и мезомерного эффектов приводит к перераспределению электронной плотности в молекуле. В результате на одних атомах концентрируется частичный отрицательный, а на других – частичный положительный заряды. В свою очередь, это перераспределение зарядов определяет реакционную способность соединений, их кислотно-основные свойства, дипольный момент молекул, силу межмолекулярных связей (а значит и такие свойства как темперутуры кипения и плавления, растворимость).
Дата добавления: 2018-11-25; просмотров: 1473;
