Химическая кинетика. Химическое равновесие. Правило Ле Шателье-Брауна.
Характер смещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле Шателье: если на систему, находящуюся в равновесии оказывается воздействие извне, то равновесие в системе смещается так, чтобы ослабить внешнее воздействие.
1. Влияние концентраций:
Повышение концентрации одного из реагирующих веществ смещает равновесие в сторону расходования вещества. Понижение концентрации - в сторону образования вещества.
2. Влияние температуры:
Повышение температуры смещает равновесие в сторону реакции, идущей с поглощением теплоты (эндотермической), а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты (экзотермической).
3. Влияние давления:
Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением объема и, наоборот, понижение давления - в сторону реакции, идущей с увеличением объема.
Пример 1: Как сместится химическое равновесие при синтезе аммиака в экзотермической реакции?
Решение: При повышении температуры в экзотермической реакции
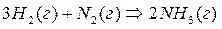
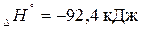
реакция протекает с выделением теплоты, равновесие должно сдвигаться влево (в сторону исходных веществ).
Скорость реакции:
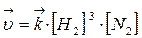 | ||
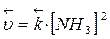 |
При увеличении давления в три раза концентрация веществ увеличивается также в три раза:
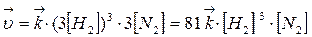
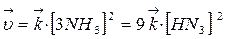
Такое изменение концентрации увеличивает скорость прямой реакции в 81 раз, а обратное в 9 раз, т.е. при увеличении давления в три раза состояние равновесия достигается быстрее в 81 : 9 = 9 раз. В левой части уравнения участвуют 3+1=4 моль вещества, а в правой части уравнения получается 2 моль, поэтому увеличение давления приводит к повышению выхода целевого продукта, что подтверждает принцип Ле Шателье.
Дата добавления: 2018-11-25; просмотров: 504;
