ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
Протоплазма живых клеток и тканей относится к сложным коллоидным системам. В таких системах возможно либо движение дисперсной фазы относительно дисперсионной среды под влиянием электрического поля, либо возникновение разности потенциалов между дисперсной фазой и дисперсионной средой при наличии разности гидростатического давления или градиента силы тяжести.
Эти явления получили название электрокинетических.
К электрокинетическим явлениям относятся: электрофорез – движение дисперсной фазы по отношению к дисперсионной среде в электрическом поле; электроосмос – движение дисперсионной среды относительно неподвижной дисперсной фазы (например пористой перегородки), происходящее под влиянием электрического тока; потенциалы течения (протекания) – потенциалы, возникающие в результате движения жидкости через капилляр или через поры пористой перегородки под влиянием разности гидростатического давления; потенциалы оседания (седиментации), т. е. потенциалы, возникающие в гетерогенной системе под влиянием силы тяжести между верхними и нижними слоями системы.
Все эти явления так или иначе связаны с возникновением скачка потенциала на границе между дисперсной фазой и дисперсионной средой.
Такой потенциал получил название электрокинетического.
В зависимости от заряда частиц различают катафорез – движение к катоду и анафорез – движение к аноду.
В связи с тем, что электрокинетический потенциал возникает в очень тонком слое жидкости, непосредственно прилегающем к дисперсной фазе, и притом в направлении, перпендикулярном к направлению движения среды (или фазы), непосредственное измерение электрокинетического потенциала не представляется возможным. О его величине можно судить только косвенным путем, измеряя скорость движения частиц, образующих дисперсную фазу, или скорость движения дисперсионной среды в электрическом поле.
В настоящем «Практикуме» разбираются явления электрофореза.
ЭЛЕКТРОФОРЕЗ
Как уже указывалось, электрофорезом называется движение взвешенных частиц по отношению к дисперсной среде, происходящее под влиянием электрического поля.
Одной из основных задач при изучении электрофореза является измерение величины ζ-потенциала, т. е. потенциала между тончайшей водной пленкой, которая адсорбирована поверхностью частицы, и всей остальной массой раствора.
Величина ζ-потенциала в норме относительно постоянна для поверхности данного вида клетки тех или иных ее органоидов. Однако эта величина может подвергаться изменениям при действии на клетку различных повреждающих факторов, поверхностно-активных веществ, антибиотиков и т. д. Поэтому метод электрофореза используют для оценки функционального или патологического состояния клеток или одноклеточных организмов.
Для измерения ζ-потенциала и для наблюдения за ходом электрофореза применяют специальные микрокамеры. В зависимости от их геометрической формы и устройства различают плоские и цилиндрические, замкнутые и открытые камеры.
Плоскую камеру для исследования катафореза, например на дрожжевых клетках, эритроцитов можно легко изготовить в лаборатории. Для этого на широкое предметное стекло наклеивают покровные стекла, образующие камеру, как показано на рис. 58. Приклеивать стекла можно специальной замазкой (сплав воска и канифоли, взятых в равных количествах) или пицеином. На два других предметных стекла приклеивают по две маленькие пробирки с плоскими донышками, которые служат стаканчиками для растворов CuSO4 и KCI. Из стеклянных трубок вытягивают U-образные трубочки и сифончики.
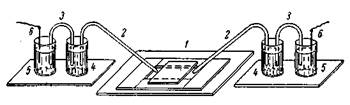 Рис. 58. Установка для измерения ζ-потенциала:
1-камера с крышкой, 2- агаровые сифоны, 3-соединительные трубки, 4- стаканчики с раствором КС1, 5- стаканчики с раствором CuSO4, 6- металлические электроды.
Рис. 58. Установка для измерения ζ-потенциала:
1-камера с крышкой, 2- агаровые сифоны, 3-соединительные трубки, 4- стаканчики с раствором КС1, 5- стаканчики с раствором CuSO4, 6- металлические электроды.
|
В сифончики и U-образные трубочки насасывают 3-процентный раствор агар-агара, приготовленный на насыщенном растворе KCI. Для приготовления этого раствора навеску агар-агара тщательно измельчают ножницами (для большего измельчания можно еще растереть кусочки агар-агара в ступке) и размачивают в воде в течение 2-3 ч. Набухший гель нагревают на кипящей водяной бане до полного расплавления агар-агара. К раствору добавляют необходимую навеску KCI. При охлаждении раствор агар-агара застывает, поэтому перед насасыванием в сифончики его следует подогревать.
Электрическую схему собирают, как показано на рис. 59. Источником тока служит аккумуляторная батарея или сухая анодная батарея на 80-100 в. В качестве потенциометра в цепь вводится реостат Рустрата с сопротивлением 4-5 кОм. Параллельно потенциометру включают вольтметр. К камере, в которой производятся измерения, ток подается через коммутатор, что позволяет легко менять направление тока. Ток подается к медным проводникам, погруженным в стаканчики, содержащие насыщенный раствор CuSO4. Эти стаканчики соединены с другими, в которые налит 10-процентный раствор KCI.
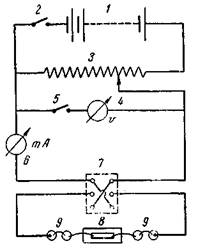
| Рис. 59. Схема установки для микроэлектрофореза: 1— батарея, 2 и 5— ключи, 3— потенциометр, 4—вольтметр,6 —миллиамперметр, 7—коммутатор, 8—камера, 9— неполяризующиеся электроды |
Последние при помощи агаровых сифончиков соединяются с камерой. Для измерения силы тока в цепь включается милиамперметр на10-20 мА. Камеру помещают на предметном столике микроскопа, а неполяризующиеся электроды ставят на подставки, находящиеся по обе стороны микроскопа.
Проведение измерений.Объект исследования, например взвесь дрожжевых клеток, помещают в камеру. К камере подводят сифончики (см. рис. 58). Наблюдения за движением частиц ведут через микроскоп, окуляр которого снабжен сеткой. Цену делений сетки предварительно определяют при помощи объект-микрометра.
Установив переключатель в одно из двух возможных положений, замыкают ключ 2 (см. рис. 59) и, меняя положение движка потенциометра, устанавливают в цепи нужный для работы ток. Измерив скорость движения клеток, меняют направление тока в цепи и вновь определяют скорость движения. Следует каждый раз отмечать, в каком направлении, т. е. от « + » к «—» или от «—» к « + », двигались клетки. Для определения глубины камеры фокусируют объектив при помощи микровинта микроскопа сначала на покровное стекло, а затем на дно камеры. Отмечают в том и другом случае деления на головке микровинта. Затем поворачивают головку винта так, чтобы показания на головке соответствовали 0,2 разности ранее зафиксированных показаний.
Измерение скорости движения частиц можно проводить двумя способами. По первому способу определяют время, необходимое частице, чтобы пройти расстояние между двумя делениями сетки. Для этого включают секундомер, когда частица проходит одну черту сетки, и останавливают его, когда частица достигает следующей черты.
По второму способу определяют количество делений сетки, пройденных частицей за определенный промежуток времени (например, за 30 сек.).
Зная расстояние между делениями сетки, вычисляют скорость движения частицы. При пользовании первым способом измерений производят 10-20 отсчетов. При пользовании вторым способом производят 5 измерений, по 30 сек каждое. Скорость движения частицы (клетки) в электрическом поле определяют по формуле:
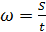 , (3.1)
, (3.1)
где S - путь, пройденный частицей (в см) за время t (в сек);ω -скорость в см/сек.
Исходя из найденной в опыте величины скорости (ω), вычисляют подвижность (электрофоретическую скорость 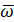 ), т. е. отношение линейной скорости к градиенту потенциала электрического поля, т. е.
), т. е. отношение линейной скорости к градиенту потенциала электрического поля, т. е.
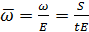 , (3.2)
, (3.2)
где Е — напряженность поля в см-1 ; тогда размерностью 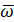 в электротехнических единицах является см2сек-1 в-1 .
в электротехнических единицах является см2сек-1 в-1 .
Зная градиент потенциала (напряженность поля Е) и определив скорость движения частицы можно вычислить величину ζ-потенциала по 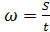 формуле:
формуле:
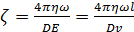 (3.3)
(3.3)
где η— вязкость среды, равная для воды при +20°С 0,01 (10-2 г*см-1 сек-1); l - длина камеры (расстояние между электродами) в см.
В формуле (3.3) размерность v и соответственно ζ – равна (в единицах СГСЕ) 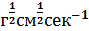
Помня, что 1в=1/300 абсолютной электростатической единицы потенциала, выразим потенциал в вольтах. Для этого необходимо умножить правую часть уравнения (3.3) на 300. В итоге получаем:
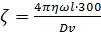 (3.4)
(3.4)
Поскольку, однако, напряжение измеряют в вольтах (а не в абсолютных электростатических единицах потенциала), следует разделить знаменатель правой части равенства (3,4) на 300, т. е.:
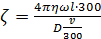 (3.5)
(3.5)
Подставляя вместо η и D их численное значение для воды 0,01 и 81, считая π равным 3,14, имеем:
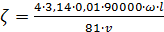 , (3.6)
, (3.6)
Принимая ω=S/t и v/l=E, имеем:
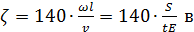 или
или 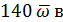 . (3.7)
. (3.7)
Пример:определение величины электрокинетического потенциала дрожжевой клетки. Дрожжевые клетки помещены в забуференную среду рН 5,8. Напряжение в цепи равно 50 в. Расстояние между концами агаровых сифонов составляет 2 см. Цена деления сетки окуляр-микрометра равна 15*10-4 см. Время прохождения дрожжевой клеткой расстояния, равного десяти делениям сетки, соответствует 5 сек.
Вначале вычисляем величину подвижности (электрофоретической скорости) дрожжевой клетки, подставляя в формулу численное значение s, равное 15*10-4*10,и, соответственно, значения для v, l и t:
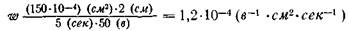
Полученное на основании опытных данных значение для ω подставляем в формулу (3.7) и получаем:
140*1,2*10-4 =168*10-4 =16,8 мв.
Лабораторная работа 1.
Определение электрофоретической скорости и ζ-потенциала дрожжевых клеток
Необходимые принадлежности:микроскоп; окуляр-микрометр (сетка); объект-микрометр; камера для электрофореза; сосудики для неполяризующихся электродов; сифоны и (U-образные трубки; источник постоянного тока на 80-100 в (сухие батареи и аккумуляторная батарея); ключ 2-клеммный; вольтметр постоянного тока на 100-150 в; миллиамперметр постоянного тока на 10-20 ма; провод в хлорвиниловой изоляции (2-3 м); агар-агар; растворы: насыщенный раствор CuSO4; насыщенный раствор KC1; 10-процентный раствор KCI, 8-процентный раствор сахарозы; 15-процентный раствор сахарозы; буферная смесь по Мак-Ильвену; гликоколевый буфер; дрожжи; элодея1.
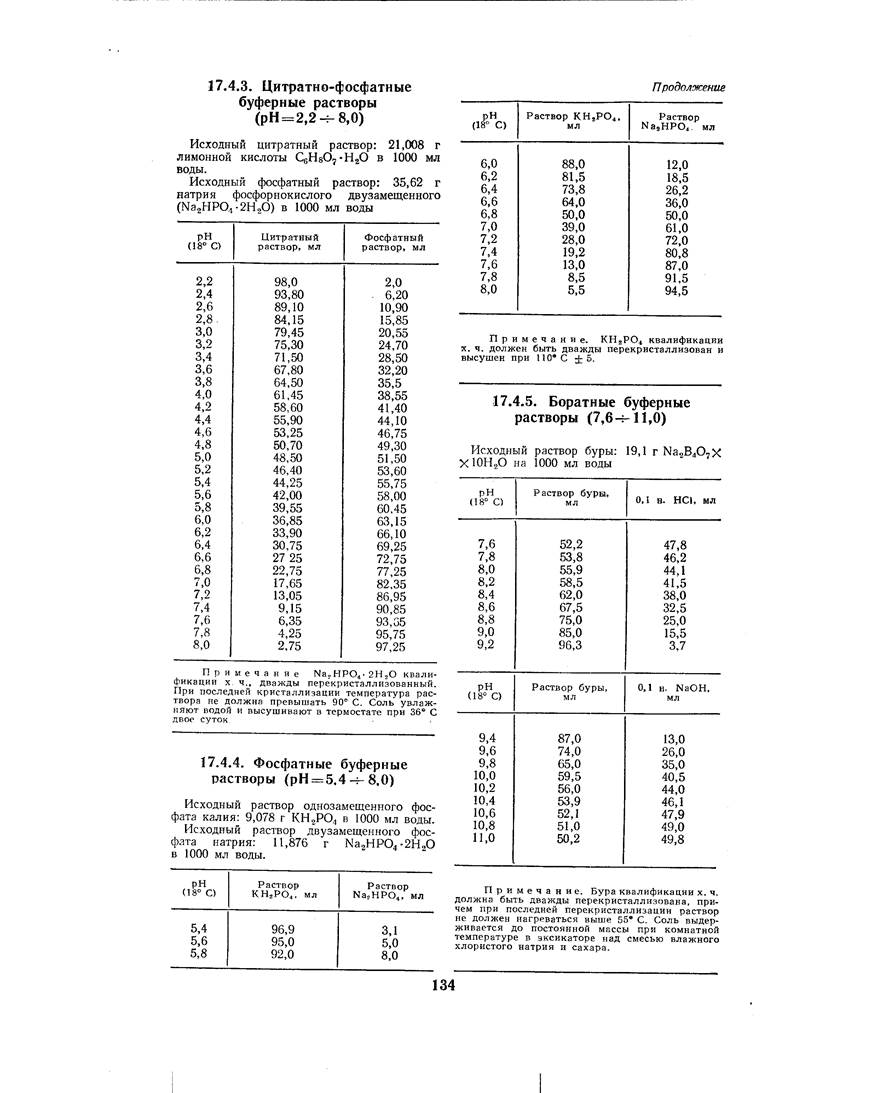
Небольшой кусочек палочки обычных продажных дрожжей помещают в колбу с 8-процентным забуфе-ренным раствором сахарозы и тщательно размешивают стеклянной палочкой. Для забуферивания применяют цитратный буфер по Мак-Ильвену. Раствор готовят из расчета 9 объемов 8-процентного раствора сахарозы и 1 объема буферного раствора рН 8,0.
Каплю приготовленной взвеси дрожжевых клеток просматривают под микроскопом, и если взвесь слишком густа и неудобна для наблюдения, разбавляют ее в несколько раз тем же раствором.
Каплю взвеси помещают в камеру для катафореза и устанавливают камеру на столике микроскопа так, чтобы середина ее находилась в центре поля зрения.
Убедившись, что дрожжевые клетки в камере не находятся в движении под влиянием пристеночных токов, замыкают электрическую цепь, устанавливают в цепи силу тока порядка 3-4 мА и измеряют скорость движения дрожжевых клеток одним из двух описанных выше способов. Проделав необходимое число замеров, меняют направление тока в камере и повторяют измерения.
Расчеты делаются по рассмотренным ранее формулам.
Лабораторная работа 2.
Определение изоэлектрической точки дрожжевой клетки
Приготовляют ряд растворов, из которых каждый содержит на 9 объемов 8-процентного раствора сахарозы и 1 объем буферного раствора по Мак-Ильвену1 рН: 2,6; 3,5; 4,6 5,8; 8,0. В растворы помещают дрожжевые клетки и проводят определения для всех пяти растворов тем же порядком, что и в предыдущей работе. При этом надо следить за тем, чтобы сила тока в цепи при всех определениях была одинакова.
Определяют скорость электрофореза при указанных значениях рН и вычисляют величину ζ-потенциала.
То значение рН, при котором скорость катафореза наименьшая, соответствует изоэлектрической точке поверхности дрожжевой клетки.
Лабораторная работа 3.
Изучение внутриклеточного электрофореза в листьях элодеи
Для изучения внутриклеточного электрофореза в листьях элодеи необходимо предварительно произвести плазмолиз клеток листа. Для этого оторванные от стебля листочки элодеи помещают в 15-процентный раствор сахарозы, забуференный гликоколевым буфером, имеющим в одном случае рН 3,0, а в другом рН 9,0. К 9 объемам раствора сахарозы следует прибавить 1 объем того или другого буферного раствора. Стаканчики с растворами и погруженными в них листочками элодеи ставят в термостат при температуре 30° С на 30-45 мин.
Проверив под микроскопом полноту плазмолиза, листок элодеи помещают в камеру для катафореза в том же растворе, в каком проводился плазмолиз. Листок располагают в камере так, чтобы длинная ось клетки совпадала с направлением тока.
Включив ток порядка 10-20 ма, наблюдают медленное передвижение протопластов. Большинство находящихся в поле зрения протопластов займет крайнее положение в своих клетках.
Затем изменяют направление тока, наблюдают движение протопластов в обратном направлении, и когда они достигнут противоположного конца клеток, снова записывают время движения.
Расчеты проводят по приведенным выше формулам.
Вопросы для самоконтроля.
1. Что такое поверхностный заряд клетки (белка).
2. Что такое дзета-потенциал?
3. Что такое изоэлектрическая точка?
4. Какие сведения можно получить о свойствах поверхности частицы путем определения ее дзета-потенциала, электрофоретической скорости, изоэлектрической точки?
Литература
Большой практикум по физиологии человека и животных. Под ред. Л. Л. Васильева и И. А. Ветюкова. М. изд-во «Советская наука», 1954.
Булл Г. Б. Физическая биохимия. ИЛ, 1949.
Бурлакова Е. В., Кольс О. Р., Кригер Ю. А. Практикум по общей биофизике. Вып. I. Физико-химические методы в биологии. М., изд-во «Советская наука», 1958.
Бурлакова Е. В., Вепринцев Б. Н., Кольс О. Р., Кригер Ю. А. Практикум по общей биофизике. Вып. III—IV. Исследования биоэлектрических явлений в тканях и клетках. М., изд-во «Высшая школа», 1961.
Гинецинский А. Г. и Лебединский А. В. Основы физиологии человека и животных. М., Медгиз, 1947.
Гуляев П. А. и Жуков Е. К. Методы электрофизиологических исследований. Л., изд-во, ЛГУ, 1948.
Митрофанов П. П. и Северин С. Е. Учебник физической и коллоидной химии. Изд. 2-е, М., Медгиз, 1948.
Насонов Д. Н. Местная реакция протоплазмы и распространяющееся возбуждение. М., изд-во АН СССР, 1959.
Работнова И. Л. Роль физико-химических условий (рН и rН2) в жизнедеятельности микроорганизмов. М., 1957.
Рубинштейн Д. Л. Общая физиология. М., Медгиз, 1947.
Тарусов Б. Н. Электропроводность как метод определения жизнеспособности тканей. «Архив биологических наук», т. 52, вып. 2, 1938.
Тарусов Б. Н. Основы биофизики и биофизической химии. М., изд-во «Высшая школа», 1960.
Хомазюк В. Г. Практикум по общей биофизике. Вып. II. Основы электроники. М., изд-во «Советская наука», 1958.
| <== предыдущая лекция | | | следующая лекция ==> |
| Повышение психологической компетентности воспитателей ДОУ | | | Dependence of Rates on Concentration |
Дата добавления: 2018-11-25; просмотров: 541;
