Химические свойства
I. Кислотно-оснóвные
АК за счет –I группы –NH2 являются более сильными к-тами, чем соответствующие им карбоновые к-ты и более слабыми основаниями, чем амины.
a-АК являются амфотерными соединениями, т.к. содержат в одной молекуле –NH2 гр., обусловливающую оснóвные св-ва и –СOOH – кислотные. Поэтому в зависимости от среды АК могут существовать в р-ре в виде катионов или анионов. В кислой среде протонируется –NH2 гр., в щелочной – –COOH гр. превращается в анион –СОО- . В среде близкой к нейтральной АК существует в виде диполярного иона:
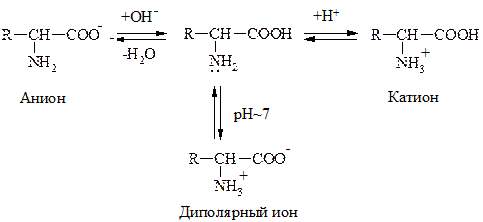
Значение рН р-ра, при котором АК имеет равное количество положительных и отрицательных зарядов, наз-ся изоэлектрической точкой (ИЭТ). Заряд белковой молекулы определяется суммой ионогенных групп –NH3+ и –COO–.
Изображение АК в неионизированной форме является упрощенным.
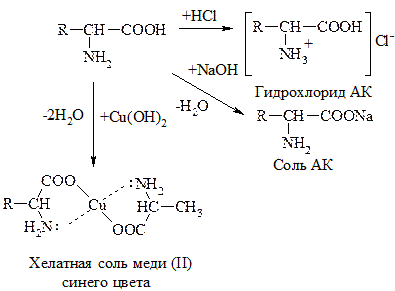
АК, как амфотерные соединения, образуют соли как с к-тами, так и с основаниями:
II. Р-ции по –СООН группе
АК могут диссоциировать, образовывать соли, сложные эфиры, ангидриды, амиды, хлорангидриды.
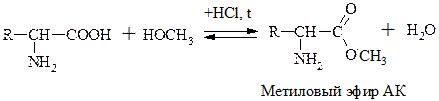
Эта р-ция используется как “защитная” в синтезе белков и пептидов.
III. Р-ции по –NH2 группе
а) Р-ция солеобразования (см.выше)
б) Р-ция с HNO2
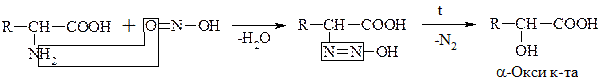
Эта р-ция дезаминирования in vitro. По количеству выделившегося азота определяют кол-во АК (метод Ван-Слайка).
в) Хлорангидриды и ангидриды к-т образуют с АК ацилпроизводные (подобно аминам и мочевине):
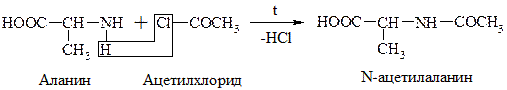
Эта р-ция используется для “защиты” –NH2 гр. в синтезе белков и пептидов.
г) Р-ция с формальдегидом
При взаимодействии с альдегидами a-АК, подобно первичным аминам, образуют основания Шиффа. Для аналитических целей применяется р-ция a-АК с формальдегидом, останавливающаяся на стадии N-гидроксиметильного производного АК (гидроксиметильной наз-ся гр. –СН2ОН):
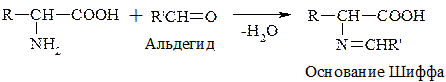
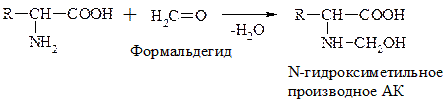
Последняя р-ция лежит в основе метода формольного титрования. Сами АК вследствие амфотерности не могут быть оттированы щелочью.
N-гидросиметильные производные АК содержат свободную –СООН гр. и могут быть определены количественно титрованием щелочью.
IV. Отношение АК к нагреванию
а) a-АК при нагревании могут отщеплять одну или две молекулы воды. При отщеплении одной молекулы воды образуются дипептиды:
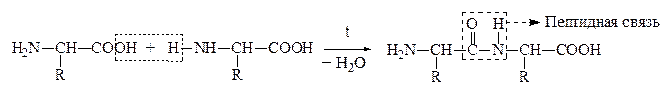
Дипептид обладает способностью взаимодействовать с новой молекулой АК с образованием трипептида, тетрапептида и полипептида. Последний является основой белковых молекул. Название ди– и полипептидов строится по названиям тех к-т, из которых они образуются. Поэтому АК, участвующая в образовании пептида имеет окончание –ИЛ, а концевая АК, сохранившая гр. –СООН – полное название:
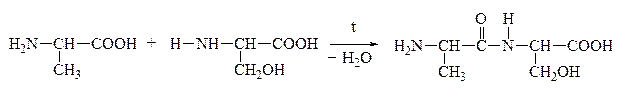
Аланин Серин АланИЛсерин
Используется сокращенная запись полипептида с указанием концевых групп и названий АК первыми тремя буквами русского или латинского алфавита:
Н2N – Ала – Тир – Гли – Глу – СООН
Аla Tyr Gly Glu
При отщеплении двух молекул воды от двух молекул АК образуется дикетопиперазин (циклический амид):



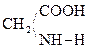 +
+ 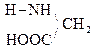
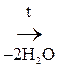
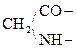
Глицин Дикетопиперазин
б) b-АК выделяют при нагревании NH3 и образуют непредельную к-ту, т.е. идет р-ция дезаминирования:
|
|

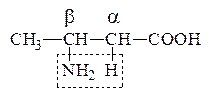
СН3–СН=СН–СООН
b-Аминомасляная к-та
в) g-АК образуют лактамы:

Лактамная
(пептидная) группа
|
g-Аминомасляная к-та
V. Р-ции дезаминирования:
В организме человека и животных под действием различных ферментов происходят процессы дезаминирования. Во всех случаях гр. -NH2 освобождается в виде NH3, а продуктами дезаминирования могут быть жирные к-ты, окси- и кеток-ты. При этом окислительное дезаминирование преобладает :
а) Окислительное дезаминирование
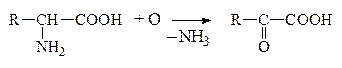
Оксок-та
б) Восстановительное
|
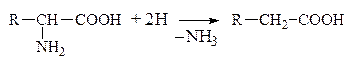
в) Гидролитическое
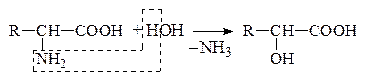
Оксик-та
г) Внутримолекулярное
|
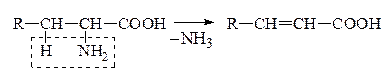
VI. Р-ции декарбоксилирования
Карбоновые к-ты in vitro декарбоксилируются в очень жестких условиях. Введение в a-положение ЭА групп -NH2, 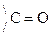 , –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
, –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
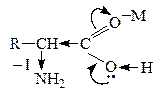
В лабораторных условиях АК легко декарбоксилируются в щелочной среде. В организме a-АК декарбоксилируются под действием фермента декарбоксилазы:
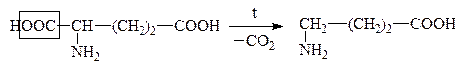
Глутаминовая к-та g-Аминомасляная к-та, ГАМК
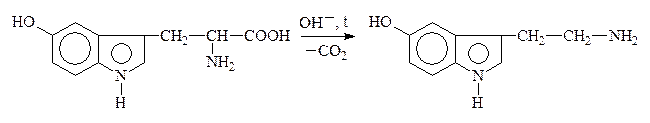
5-Окситриптофан 5-Окситриптамин,
серотонин
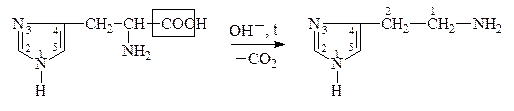
Гистидин, Гистамин,
a-амино-b-[4(5)-имидазолил]- 2-имидозолиламиноэтан,
пропионовая к-та 4(5)-аминоэтилимидазол
Образующиеся амины имеют большое физиологическое значение и наз-ся биогенными аминами. Они участвуют в ряде р-ций обмена нервной и сердечно-сосудистой систем. Нарушение обмена биогенных аминов влечет за собой возникновение патологических состояний, в частности, некоторых психозов, аллергических заболеваний, воспалительной и болевой реакций. Так, гистамин является сосудорасширяющим соединением, понижает кровяное давление. ГАМК играет большую роль в жизнедеятельности нервной системы, где не только обезвреживает NH3, но и влияет на дыхание, проведение нервных импульсов.
К биогенным аминам, образующимся из тирозина в процессе обмена веществ, относится группа катехоламинов: адреналин, норадреналин и дофамин:
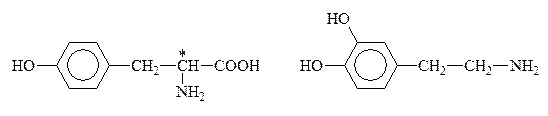
Тирозин Дофамин
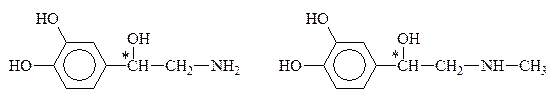
Норадреналин Адреналин
Дофамин, норадреналин и адреналин выполняют роль нейромедиаторов. Адреналин (5мг) является гормоном мозгового вещества надпочечников, а норадреналин и дофамин – его предшественниками. Адреналин участвует в регуляции сердечной деятельности, обмена углеводов. При физиологических стрессах он выделяется в кровь (“гормон страха”). Активность адреналина связана с конфигурацией хирального центра, определяющей взаимодествие с рецептором. Подобно 1,2-дигидроксибензолу, катехоламины с р-ром FeC13 дают изумрудно-зеленое окрашивание, переходящее в вишнево-красное при добавлении р-ра аммиака, что может служить качественной р-цией на эти соединения.
Из тирозина синтезируются также пигменты кожи, глаз, волос.
Кроме р-ций декарбоксилирования в организме протекают под влиянием ферментов много строго специфических р-ций: переаминирования, трансаминирования и др.
VII. Р-ции по радикалу
Все циклические АК, содержищие бензольное кольцо – триптофан, тирозин, фенилаланин – легко вступают в р-ции замещения по бензольному кольцу с На12, НО–NO2, HO–SO3H.
Путем йодирования тирозина в организме образуется гормон щитовидной железы тироксин:
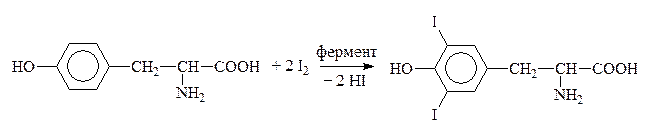
Тирозин Дийодтирозин
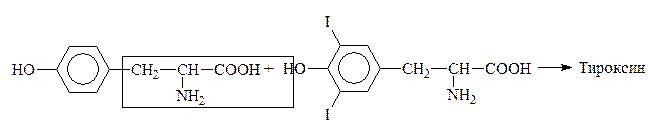
Качественная р-ция на ароматические АК – ксантопротеиновая – обусловлена нитрованием бензольного кольца с образованием нитросоединений желтого цвета. При добавлении к ним щелочи возникает оранжевое окрашивание:
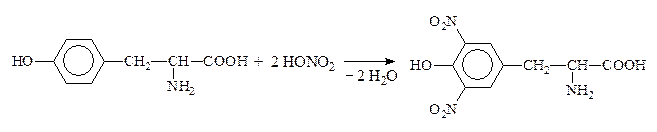
VIII. Качественная р-ция на a-АК
Это р-ция с нингидрином:
a-AK
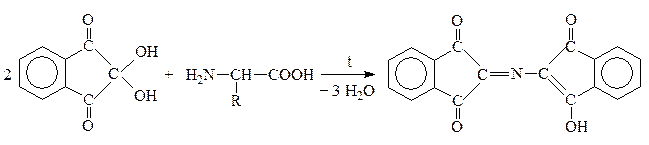 Нингидрин Продукт р-ции сине-фиолетового цвета
Нингидрин Продукт р-ции сине-фиолетового цвета
+ CO2 + R–CHO
Альдегид
IX. Р-ция на присутствие серусодержащих АК
|
|
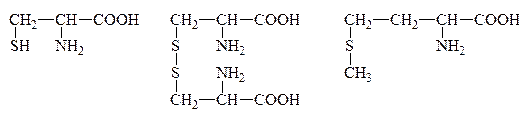
Цистин
Цистеин и цистин легко превращаются друг в друга за счет р-ции окисления-восстановления:
Цистеин 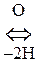 Цистин + Н2О
Цистин + Н2О
Обмен серы в организме идет, в основном, за счет цистина и цистеина. Они обусловливают структуру белка, реактивность многих ферментов и гормонов. За счет ферментативного окисления серы образуется H2SO4, которая вступает во взаимодействие с ядовитыми веществами, обезвреживая их.
Качественной р-цией на серусодержащие АК является р-ция Фоля:
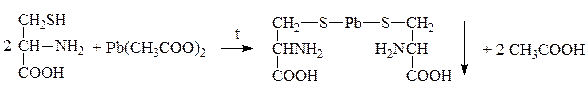
Коричневый
Метионин играет большую роль в обмене сложных липидов, препятствуя синтезу нейтральных жиров и холестерина, т.к. является донором метильных групп, содержится в большом количестве в сыре, твороге.
По оценкам американских врачей повышенный уровень цистеина, всегда присутствующего в крови, ассоциируется с 10–15% инфарктов и 30–40% инсультов. Избыток цистеина обычно обусловлен нехваткой фолиевой к-ты и витаминов группы В.
Применение АК
ГАМК в медицине под названиям аминалон (гаммалон) применяется при психических заболеваниях, обладает ноотропным действием, т.е. влияет на процессы мышления. На основе ГАМК создан ряд новых ноотропных средств:
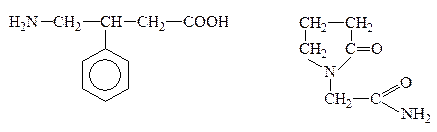
Фенибут Пирацетам, ноотропил
 H2N–(CH2)5–CООН e-аминокапроновая к-та получается гидролизом e-капролактама. В медицине используется в качестве кровоостанавливающего средства. e-Капролактам (синтезируется из фенола) применяют для получения капрона.
H2N–(CH2)5–CООН e-аминокапроновая к-та получается гидролизом e-капролактама. В медицине используется в качестве кровоостанавливающего средства. e-Капролактам (синтезируется из фенола) применяют для получения капрона.
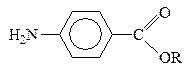
парааминобензойная к-та (ПАБК)
Получают из паранитротолуола. Сложные эфиры ПАБК (анестезин и новокаин) используются в качестве местноанестезирующих средств:
|
|
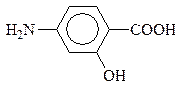
ЛЕКЦИЯ 13
Белки
Это биополимеры, состоящие из ста и более АК остатков.
Классификация: простые белки (протеины), состоящие из a-АК, сложные белки (протеиды), состоящие из белковой и небелковой частей.
Аминокислотный состав определяет многие св-ва белков: заряд белковой молекулы, ИЭТ, способность к осаждению, структуру и биологическую активность.
В настоящее время синтезированы простейшие белки – инсулин, рибонуклеаза, окситацин и др.
Первичная структура
При всем многообразии пептидов и белков принцип построения их молекул одинаков – связь между a-АК осуществляется за счет –СООН гр. одной АК и –NH2 гр. другой АК, которая в свою очередь своей карбоксильной группой связывается с аминогруппой третьей АК и т.д. Связь между остатками АК, а именно между группой С=О одной к-ты и группой NH другой к-ты, является амидной связью. В химии пептидов и белков она наз-ся пептидной связью:





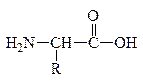




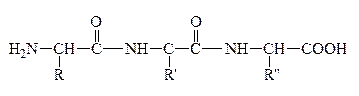
Пептидная связь
N-конец С-конец
Формально белковая или пептидная цепь представляет собой продукты поликонденсации АК. Один из концов цепи, где находится остаток АК со свободной аминогруппой, наз-ся N-концом (а сама АК – N–концевой), а другой конец цепи с остатком АК, имеющим свободную карбоксильную группу, наз-ся С–концом (а к-та - С-концевой). Т.о., пептидная цепь построена из повторяющихся скелет молекулы, и отдельных боковых групп – радикалов R, R/,R//.
Первичная структура пептидов и белков – это последовательность аминокислотных остатков в полипептидной цепи.
Сведения о последовательности a-АК остатков в цепи могут быть получены в результате постепенного, шаг за шагом, отщепления АК с одного конца цепи последующей идентификацией отщепленной a-АК. Такие методы существуют, и с их помощью установлена первичная структура многих пептидов и белков.
Для синтеза белка важен не только набор АК, но и порядок их соединения, т.е. первичная структура. Последняя обусловливает активность белков. Определенную последовательность АК в цепи дает использование операции “защита”.
1. “Защита” –NH2 гр. проводится методом ацилирования АК хлорангидридом или ангидром к-ты или на практике карбобензоксихлоридом (бензиловым эфиром хлормуравьиной к-ты):
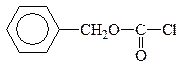
|
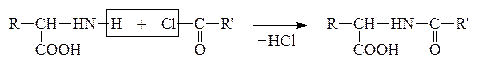
Ацилхлорид
2. “Защита” –СООН гр. проводится путем образования сложного эфира:
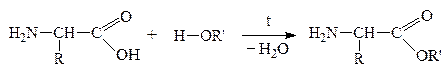
Затем проводят р-цию взаимодействия защищенных молекул в присутствии водоотнимающих средств. В этих условиях реагируют строго определенные группы –СООН первой молекулы и –NH2 – второй:

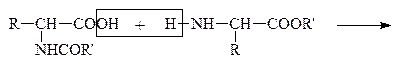
|
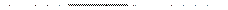
Затем проводят гидролиз в мягких условиях с освобождением защищенных групп и сохранением пептидной связи:
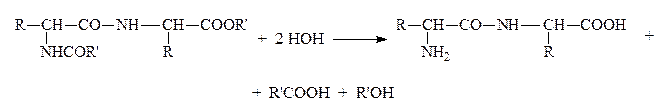
Стратегию пептидного синтеза разработал и осуществил Э.Фишер еще в начале ХХв. Последовательным наращиванием цепи из АК он синтезировал (1907) первое белковоподобное вещ-во, состоящее из 18 АК. Он показал, что АК являются “строительным материалом” белков. Он был автором гипотезы “ключа и замка”, объясняющей специфичность действия белковых катализаторов-ферментов.
Задача химического синтеза белковых макромолекул пока еще слишком сложна (и экономически неоправданна), но получение химическим путем относительно коротких пептидов в настоящее время вполне реально. Достижения в области синтеза пептидов позволяют автоматизировать процесс и вести его по заданной программе. С помощью приборов (синтезаторов) получены пептиды, содержащие десятки АК, и даже некоторые белки. Аналогично синтезу пептидов автоматизации поддается и метод анализа перичной структуры пептидов.
Вторичная структура
Цепи пептидов и белков принимают в пространстве определенную более или менее компактную форму. Уникальная особенность белковых молекул заключается в том, что они имеют, как правило, четкую пространственную структуру, или конформацию. В данном случае понятие конформации применяется для пространственного строения длинных полипептидных цепей. Как только молекула окажется развернутой или уложенной иным способом в пространстве она почти всегда теряет свою биологическую функцию.
Л.Полинг, Р.Кори (1951) на основании расчетов предсказали наиболее выгодные способы укладки цепей в пространстве.
Пептидная цепь может укладываться в виде спирали (подобно винтовой лестницы). В одном витке спирали помещается около четырех АК остатков. Закрепление спирали обеспечивается водородными связями между группами С=О и NН, направленными вдоль оси спирали. Все боковые радикалы R АК находятся снаружи спирали. Такая конформация наз-ся a-спиралью. Другой вариант упорядоченной структуры полипептидной цепи – b-структура, или b-складчатый слой. В этом случае скелет находится в зигзагообразной конформации, и цепи располагаются параллельно друг другу, удерживаясь Н-связями.
Вторичная структура белка – это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет Н-связей между пептидными группами.
Конформация белковой молекулы стабилизируется не только Н-связями, но и за счет некоторых ионных взаимодействий, а также за счет окисления SН-групп боковых радикалов R возникает ковалентная дисульфидная связь.
Третичная структура
Это укладка полипептидной цепи, включающей элементы той или иной вторичной структуры в пространстве, т.е. образование трехмерной конфигурации белка.
Чаще всего это – клубок. Стабилизируют третичную структуру Н-связи, электростатическое взаимодействие заряженных групп, межмолекулярные силы Ван дер Ваальса, гидрофобные взаимодействия – вызванные вталкиванием радикалов R внутрь молекулы белка молекулами воды:



|
Электрическое Ковалентные Гидрофобное
 взаимодействие связи взаимодействие
взаимодействие связи взаимодействие
Диполь-дипольное
взаимодействие
Четвертичная структура
Несколько отдельных полипептидных цепей способны укладываться в более сложные образования, называемые также комплексами или агрегатами. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуры, выступает в роли субъединицы комплекса с более высоким уровнем пространственной организацией – четвертичной структурой. Такой комплекс представляет собой единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Четвертичная структура закрепляется за счет Н-связей и гидрофобных взаимодействий между субъединичными полипептидными цепями.
Определение четвертичной структуры белковых агрегатов возможно только с помощью высокоразрешающих физикохимических методов (рентгенография, электронная микроскопия) . Четвертичная структура характерна лишь для некоторых белков, например, гемоглобина. Главная функция гемоглобина (основного компонента эритроцитов) состоит в переносе кислорода из легких к тканям организма. Его четвертичная структура – образование из четырех полипептидных цепей (субъединиц), каждая из которых содержит гем.
Физико-химичекие св-ва
Для белков характерны высокая вязкость р-ров, низкая диффузия, способность к набуханию, подвижность в электрическом поле, низкое осмотическое давление.
Белки, как и АК, амфотерны за счет свободных групп –NН2 и –СООН.
В зависимости от рН среды, соотношения кислых и оснóвных АК остатков белки несут положительный или отрицательный заряды, что и используется при электрофорезе.
Подобно биурету полипептиды и белки дают качественную р-цию с Сu(ОН)2 – красно-фиолетовое окрашивание и она наз-ся биуретовой р-цией.
Белки отличаются друг от друга по составу, форме, растворимости, биологической активности, молярной массе. Часть из них синтезируется в организме, другие должны поступать извне. Они состоят в основном из 20 АК остатков.
Строение белков было установлено на основе р-ций гидролиза. По продуктам гидролиза все белки делят на две группы:
Простые Сложные
(протеины) (протеиды)
Это белки крови: альбумин, Гемоглобин (НЬ), цитохромы,
глобулин, фибриноген и др. флавопротеиды и др.
При гидролизе простых белков При гидролизе сложных белков
образуется только АК образуются АК+др. соединения
(Ме, липиды, углеводы,
комплексные соединения и пр.)
Фибриллярные белки – это белки, молекулы которых состоят из параллельных, сравнительно вытянутых пептидных цепей, образуют палочковидные структуры. Они не растворимы и выполняют структурную и защитную функции в организме. Например, коллаген при нагревании превращается в беспорядочные клубки, получившие название желатины (в ней много глицина, гидроксипролина, гидроксилизина).
Глобулярные белки – это белки молекулы которых состоят из плотно свернутых полипептидных цепей и имеют форму, близкую к сферической. К ним относятся ферменты, антитела, гормоны, альбумин, гемоглобулин и др. Они растворимы в водно-солевых р-рах.
Некоторые белки, например, миозин и фибриноген имеют палочковидную структуру, однако хорошо растворимы в воде.
Денатурация белков
Под влиянием многих факторов пространственная структура способна разрушаться, что приводит к потере биологической активности белков. К таким факторам относятся повышенная температура, изменение рН среды, УФ – и рентгеновское излучения, механическое воздействие (встряхивание), соли тяжелых Ме, алкалоиды и др.
Денатурация белков – это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры. Денатурация редко бывает обратимой. В этих немногих случаях важно то, что беспорядочно скрученная молекула денатурированного белка самопроизвольно принимает нативную пространственную структуру с полным сохранением биологической функции.
В случаях отравления солями тяжелых Ме (ртути, свинца, серебра и др.) в качестве противоядия используют белки с повышенным содержанием кислотных групп, например яичный альбумин. Он действует как конкурент белков организма и сам связывает токсичный агент, образуя с ним нерастворимую соль, которая затем выводится из организма.
В организме содержится более 50.000 различных белков. Кожа содержит 63% от массы сухой ткани, кости – 20%, зубы – 18%.
Функции белков:
1. Питательная (энергетическая – 20-25% – на белки), 17,6 кДж/г.
2. Транспортная (переносчики различных веществ) – гемоглобин, миоглобин и др.
3. Сократительная (белки мышечных тканей) – миозин и др.
4. Структурная (пластическая) – коллаген, фиброин, мембранные белки.
5. Каталитическая (белки-ферменты) – пепсин, каталаза, уреаза и др.
6. Регуляторная (белки-гормоны) – инсулин, вазопрессин и др.
7. Защитная (белки-антитела) – g-глобулины сыворотки крови.
8. Осмотическая, буферная, водно-солевая.
ЛЕКЦИЯ 14
Гетероциклические соединения (ГЦС)
ГЦС называются молекулы, в цикл которых, кроме атомов углерода, входит один или несколько гетероатомов, чаще всего это N, О, S.
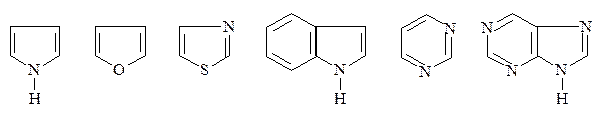
Пиррол Фуран Тиазол Индол Пиримидин Пурин
Биологическая функция
Химия ГЦС явл-ся одним из важных разделов органической химии. Многие жизненноважные сое-ния содержат гетероциклы. (ГЦ) – это ферменты (дегидрогеназа, декарбоксилаза и др.), витамины (В1, В6, В12 и др.), гормоны, алкалоиды, антибиотики (пенициллин). ГЦ входят в состав нуклеиновых к-т (НК): аденин, гуанин, тимин, цитозин, урацил – азотистые основания – материальные носители наследственности. Четыре пиррольных кольца, соединенные метиленовыми мостиками (-СН=) образуют порфириновую структуру, которая в сочетании с Fe+2 образует основу гемоглобина, с Мg+2 – хлорофилла, с Со+2 – витамина В12.
ГЦ составляет основу многих химиотерапевтических препаратов: фурацилин, фурагин – содержат ядро фурана; 5-НОК, энтеросептол – ядро хинолина; антипирин, амидопирин – ядро пиразола, орат калия – ядро пиримидина; рибоксин – ядро пурина.
Классификация
 ГЦС
ГЦС
Пиррол Имида- Пирими- Пиридин
зол дин
Конденсированными ГЦ наз-ся соединения, молекулы которых состоят из двух и более циклов, имеющих как минимум два общих атома углерода.
Номенклатура
Сложна. Поэтому широко используются тривиальные и полутривиальные названия. Некоторые закономерности можно отметить лишь для N-содержащих ГЦ.
5-членные ГЦ с двумя гетероатомами, содержащие N, наз-ся азолами. Вид второго гетероатома обозначается приставкой. Например, ОКСА – О-оксазол, тиа – S–тиазол.
6-членные ГЦ с атомом N имеют окончание -ИН. Например, пиридИН, пиримидИН.
Производные ГЦ наз-ся и по МН, и рациональной номенклатуре.
Нумерацию в кольце начинают с наиболее электроотрицательного гетероатома и продолжают в сторону наименьших номеров, обозначающих другой гетероатом, либо двойную связь, либо функциональную группу.
Если второй гетероатом располагается слева в кольце, то нумерацию ведут по часовой стрелке:


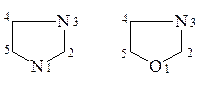
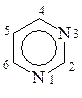
 По рациональной номенклатуре атомы, стоящие рядом с гетероатомом, обозначаются буквами греческого алфавита (a, b, g, d, e и т.д.) и строится название
По рациональной номенклатуре атомы, стоящие рядом с гетероатомом, обозначаются буквами греческого алфавита (a, b, g, d, e и т.д.) и строится название
3-метилпиридин,
b-метилпиридин,
b-пиколин
При нумерации конденсированных ГЦ важно определить главный цикл и атомы, участвующие в конденсации, т.к. они, как правило, не нумеруются. В конденсированных циклах с бензолом главным является ГЦ. В других конденсированных ГЦ главным является ГЦ с большим числом гетероатомов, либо больший ГЦ, если они одинаковы, то главным будет цикл, содержащий азот:
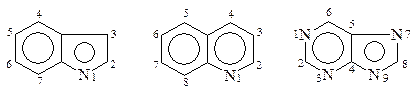
Индол Хинолин Пурин
Дата добавления: 2017-12-05; просмотров: 925;
