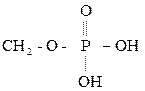Фосфатидная кислота. Фосфатиды
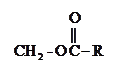
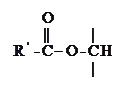
|
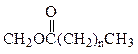 Фосфатидная к-та
Фосфатидная к-та

|
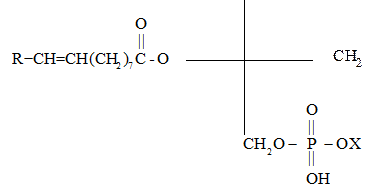
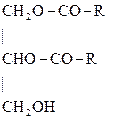
Фосфатид (общая структура)
Как правило, в природных фосфатидах в положении 1 глицериновой цепи находится остаток насыщенной, в положении 2 – ненасыщенной к-т, а один из гидроксилов фосфорной к-ты этерифицирован многоатомным спиртом или аминоспиртом.
Примерами фосфатидов могут служить фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолины – соединения, в которых фосфатидные к-ты этерифицированы по фосфатному гидроксилу серином, этаноламином и холином соответственно:
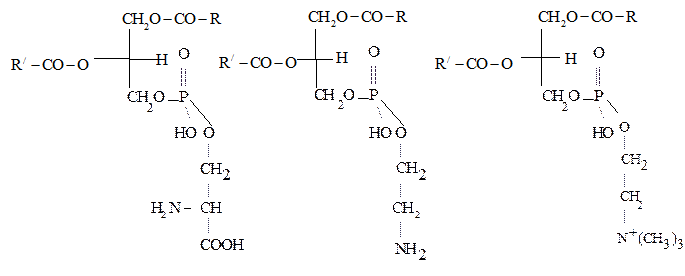 Фосфатидилсерины Фосфатидилэтаноламины Фосфатидилхолины (серинкефалины), (коламинкефалины), (лецитины),
Фосфатидилсерины Фосфатидилэтаноламины Фосфатидилхолины (серинкефалины), (коламинкефалины), (лецитины),
серинфосфатиды коламинфосфатиды холинфосфатиды
Фосфолипиды являются основными компонентами клеточных мембран. За счет атома азота и остатка фосфорной к-ты – амфотерны, а за счет дифильности – проницаемости клеточных мембран. В организме лецитин легко образуется из серинфосфатидов, если донором метильных групп является метионин:
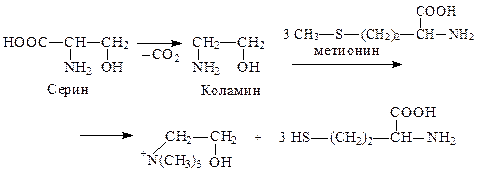 |
Следовательно, метионин является липотропным фактором в организме. Наличие нескольких функциональных групп и остатков фосфорной к-ты способствует их участию в обмене веществ. Они легко усваиваются. Поэтому, детям, людям пожилого возраста рекомендуется в диете творог, т.к. больше всего метионина содержится в белках молока.
Содержание нейтрального резервного жира и холестерина зависит от количества фосфолипидов.
В зависимости от природы азотистого основания, присоединяющегося к остатку фосфата фосфатидной к-ты, различают: серинфосфатиды, коламинфосфатиды, холинфосфатиды, инозитфосфатиды, ацетальфосфатиды (вместо остатка жирной к-ты входит высокомолекулярный альдегид в енольной форме, а основание - любое).
|
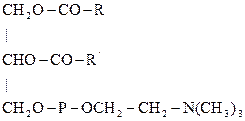
// \
О ОН


 Лецитиназа А D
Лецитиназа А D
|
|
|
|
|
|
|
|
|
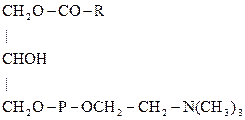
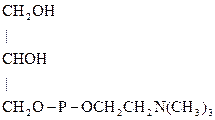
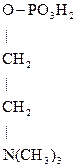
В ранах слизистой Летальное,
кишечника, плесени гемолитическое,
некротическое
действие
Лецитин, кефалин – липотропные факторы – играют важную роль в мобилизации жира. Фосфолипиды осуществляют обмен жирных к-т и глицерина за счет Н3РО4 и N-оснований.
Известно, что синтезированный в клеточной стенке жир поступает в лимфатическую систему, оттуда – в кровь и в различные жировые депо, в частности, в печень. В норме содержание нейтральных жиров составляет 1,5-2,0% от массы печени.
При увеличении жира наступает жировая инфильтрация.
1.Одной из причин является нарушение синтеза фосфолипидов из жиров, т.к. именно в виде фосфолипидов липиды транспортируются из печени к тканям.
2. Жировое перерождение может быть и при отравлении фосфором и СНС13, при сахарном диабете, поражении паренхимы печени в результате частого употребления алкоголя.
3. Последствия болезни Боткина из-за нарушения функции печени.
Сфингофосфатиды (СФ)
Принцип построения такой:
Спирт + ВМЖК + Н3РО4 + N – основание.
В качестве спирта выступает непредельный двухатомный аминоспирт – из 18 атомов углерода – сфингозин:
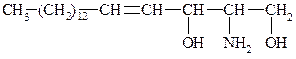
По первой спиртовой групп присоединяется Н3РО4 и к ней N–основание (коламин, холин). Жирная к-та присоединяется по гр. –NH2:
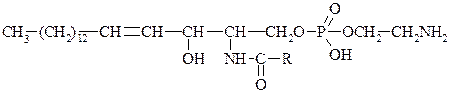
СФ входят в состав нервной ткани, оболочек нервов, печени.
Гликолипиды
Это липиды не являющиеся фосфатидами. Они состоят из СФ + ВМЖК + углеводный компонент, чаще всего b-глюкоза или b-галактоза, присоединенный по первой спиртовой группе:
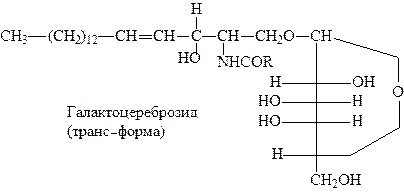
Вторым представителем сфингозинсодержащих липидов является ганглиозид. В структурном отношении ганглиозиды сходны с цереброзидами, отличаясь тем, что вместо моносахарида они содержат сложный олигосахарид.
Характерной особенностью сложных липидов является наличие полярных и неполярных группировок. В холинфосфатидах, например, углеводородные радикалы жирных к-т образуют два неполярных “хвоста”, а карбоксильная, фосфатная и холиновая группы – полярную часть. Поэтому на границе раздела фаз они действуют как эмульгаторы. В биомембранах они обеспечивают непроницаемость для неполярных. Большинство анестезирующих препаратов хорошо растворимы в липидах, что позволяет им проникать через мембраны нервных клеток.
ЛЕКЦИЯ 10
Углеводы (УВ)
Важнейший класс органических соединений, встречающийся в природе. Наиболее известны глюкоза, крахмал, целлюлоза, гликоген, гепарин и др., играющие важное значение в жизненных процессах человека и животных.
УВ – группа природных веществ, относящихся к полиоксикарбонильным соединениям, а также вещества, близкие им по строению.
В номенклатуре УВ широко используется тривиальные названия: рибоза, фруктоза и т.д.
Классификация их основана на способности к гидролизу:
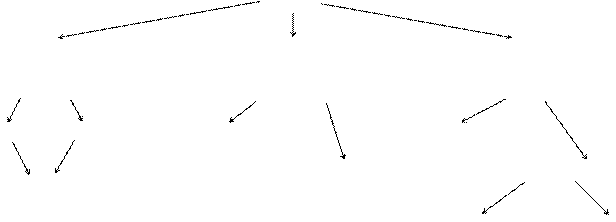 Сахара
Сахара
Моносахариды (МС) Олигосахариды(ОС) Полисахариды(ПС)
(простые сахара) (низкомолекулярные) (высокомолекулярные)
не гидролизуются гидролизуются гидролизуются
Альдозы Кетозы Восстанавливающие Гомополисахариды
Невосстанавливающие Гетерополисахариды
Тетрозы
Пентозы
Гексозы Кислые Нейтральные
Важнейшие УВ: из пентоз – рибоза, дезоксирибоза, ксилоза;
из гексоз – глюкоза, фруктоза, галактоза, манноза.
Моносахариды (МС)
Изомерия
I. Наличие нескольких асимметрических атомов углерода обусловливает существование большого числа оптических изомеров. Это и энантиомеры (зеркальные изомеры, антиподы), и диастереомеры, и эпимеры. Понятие энантиомеров и диастереомеров Вам известны.
Эпимеры – это диастереомеры, отличающиеся друг от друга конфигурацией только одного асимметрического атома С. Все изомеры, кроме зеркальных, отличаются друг от друга свойствами и имеют свое название:
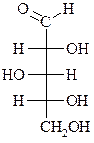 Ксилоза
Ксилоза
| 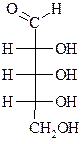 Рибоза
Рибоза
|
Принадлежность МС к D- или L-ряду определяется по конфигурации последнего (наиболее удаленного от 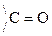 гр.) хирального атома С по аналогии со стандартом – глицериновым альдегидом:
гр.) хирального атома С по аналогии со стандартом – глицериновым альдегидом:
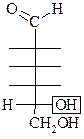 D–
D–
| 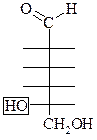 L–
L–
|
Природные сахара – D-сахара, L-сахара поступают в организм извне.
II. Для всех МС характерно явление цикло-оксо-таутомерии, или оксо-окси-таутомерии, т.е. наряду с не циклической формой они существуют и в циклических формах. В пространстве углерод-углеродная цепь изогнута,  группа располагается близко к –ОН группе 4 или 5 атома углерода. Происходит взаимодействие этих двух групп одной молекулы и образуется внутренний полуацеталь.
группа располагается близко к –ОН группе 4 или 5 атома углерода. Происходит взаимодействие этих двух групп одной молекулы и образуется внутренний полуацеталь.
Вновь образовавшийся гидроксил носит название полуацетального, или гликозидного и может по-разному располагаться в пространстве относительно цикла, образуя еще один асимметрический атом углерода в циклической форме. Если полуацетальный гидроксил располагается по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду, то такой изомер называется
a-изомером, а другой – b-изомером. Стереоизомеры, отличающиеся друг от друга расположением только полуацетального гидроксила в пространстве, называются аномерами. (b-верх, a-низ – выполняйте наш каприз! Для запоминания.)
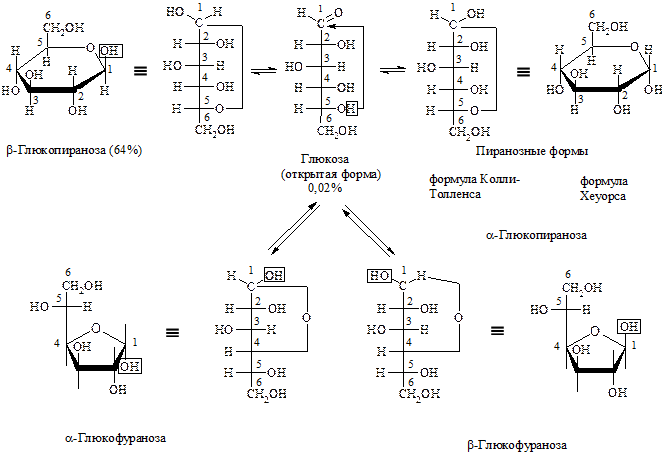
Процесс образования циклических форм называется аномеризацией. Циклическая и открытая формы легко переходят друг в друга и находятся в динамическом равновесии. При комнатной температуре преобладает циклическая, при нагревании – открытая. Для альдогексоз более характерна пиранозная форма, для пентоз и фруктоз – фуранозная. Все это отражается в названии, например, a-D-глюкопираноза. В кристаллическом состоянии циклические формы закреплены и a-, и b-изомеры стабильны и могут быть отделены друг от друга. При растворении часть молекул переходит в открытую форму, а из нее образуются все виды циклических форм. Так как каждая форма имеет свой угол вращения луча поляризованного света, то до установления динамического равновесия угол вращения будет постоянно меняться. Изменение во времени угла вращения плоскости поляризации света свежеприготовленного раствора углеводов называется мутаротацией.
В настоящее время вместо циклических формул Колли-Толленса чаще пользуются перспективными формулами Хеуорса.
Именно циклическая форма участвуют в образовании ди- и полисахаридов.
Химические свойства
Циклическая и открытая (альдегидная) формы находятся в равновесии. Поэтому возможны,р-ции, характерные для альдегидной и циклической форм.
I. Р-ции по  группе
группе
Все моносахариды взаимодействуют с НСN, РС15, NH2OH, NH2–NH2,
NH2–NHC6H5, окисляются, восстанавливаются (Н2).
В зависимости от характера окислителя и реакции среды МС могут образовывать различные продукты окисления.
1. При действии слабых окислителей: Аg2O, NH4OH, to или Cu(ОН)2, ОН–, to идет разрушение углерод-углеродной цепи с образованием оксикислот с небольшим числом атомов С, а сами окислители при этом восстанавливаются до Аg и Сu2O(Cu) соответственно. Р-ция находит применение в биохимических анализах для количественного определения сахаров в биологических жидкостях.
Р-ция Толленса:

«Зеркало»
Р-ция (проба) Троммера:
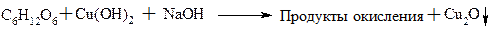
Красный
2. При осторожном окислении в кислой водной среде, например, бромной водой, образуются к-ты за счет окисления альдегидной группы – альдоновые кислоты:

| ГлюкОНОВАЯ к-та, галактОНОВАЯ к-та и др. |
3. При действии сильных окислителей идет окисление по первому и шестому атомам С с образованием аровых к-т:
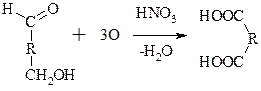
| ГлюкАРОВАЯ к-та |
4. При окислении только первичной спиртовой группы (по 6-ому атому С), если альдегидная группа защищена с образованием гликозида, получают уроновые к-ты. В организме этот процесс идет легко под действием ферментов. Уроновые к-ты способны к цикло-оксо-таутомерии. Они являются важной составной частью кислых гетерополисахаридов, например, гепарина, гиалуроновой к-ты.
II. Р-ции по спиртовым гидроксилам протекают как в открытой, так и в циклических формах.
МС взаимодействуют с Ме, Ме(ОН)2, образуя сахараты, с Сu(OH)2, с СН3I с образованием простых эфиров, с минеральными и органическими к-тами образуются сложные эфиры, с NH3 – аминосахара.
Наиболее важны фосфорные эфиры сахаров и аминосахара. Именно в виде фосфорных эфиров рибоза и дезоксирибоза входит в состав НК, соединения глюкозы и фруктозы участвуют в обмене веществ.
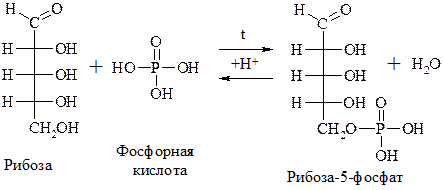
 Фруктоза + 2Н3РО4 1,6-Дифосфат фруктозы.
Фруктоза + 2Н3РО4 1,6-Дифосфат фруктозы.
Аминосахара в организме образуются довольно легко в процессе аммонолиза. Чаще всего по второму атому С:
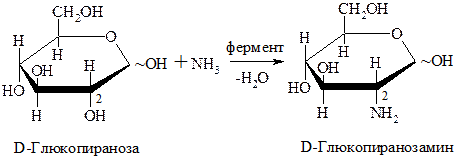
Аминосахара являются составной частью гетерополисахаридов.
III. Р-ции по полуацетальному гидроксилу
Эти р-ции характерны для циклической формы. При действии на моносахара спирта в присутствии газообразного НС1 происходит замещение атома Н полуацетального гидроксила на R с образованием особого типа простого эфира – гликозида. Р-ры гликозидов не мутаротируют. В зависимости от размера оксидного цикла гликозиды делятся на: пиранозиды и фуранозиды, как a-, так и b-форм.

Образование гликозидов служит доказательством существования циклических форм моносахаридов.
Превращение моносахарида в гликозид – сложный процесс, протекающий через ряд последовательных р-ций. Вследствие таутомерии и обратимости р-ции образования гликозида в р-ре, в равновесии в общем случае, могут находиться таутомерные формы исходного моносахарида и соответственно 4 диастереомерных гликозидов – a и b-аномеры фуранозидов и пиранозидов.
Гликозиды могут также образовываться при взаимодействии с фенолами или NH-содержащими алифатическими и гетероциклическими аминами.
Молекулу гликозида формально можно представить состоящей из двух частей: углеводной и агликоновой. В роли гидроксилсодержащих агликонов могут выступать и сами моносахариды. Гликозиды, образованные с ОН–содержащими агликонами, называются О-гликозидами, с NH-содержащими соединениями (например, аминами), наз-ся N-гликозидами.
Гликозиды являются составными частями многих лекарственных растений. Например, сердечные гликозиды, выделенные из наперстянки. Антибиотик стрептомицин – гликозид, ванилин – гликозид. Все ди- и полисахариды являются О-гликозидами.
С биологической точки зрения особое значение имеют N-гликозиды рибозы и дезоксирибозы, как продукты соединения с азотистыми пуриновыми и пиримидиновыми основаниями. Их общее название – нуклеозиды, т.к. вместе с Н3РО4 они являются нуклеиновыми к-тами – ДНК и РНК.
Все гликозиды, в том числе и нуклеозиды, легко подвергаются гидролизу в кислой среде с образованием исходных продуктов.
Гликозиды не способны к цикло-оксо-таутомерии и проявляют р-ции, характерные для спиртов.
IV. Специфические р-ции
1. Действие разб. р-ров щелочей
Эпимеры: глюкоза, фруктоза и манноза легко превращаются друг в друга, образуя равновесные системы. Этот процесс наз-ся эпимеризацией.
2. Действие конц. р-ров к-т
Конц. р-ры НС1 и Н2SО4 вызывают дегидратацию моносахаридов: из пентоз образуется фурфурол, из фруктозы – 5-гидроксиметилфурфурол.
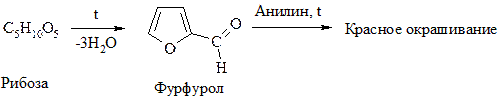

3. Брожение
Это распад моносахаридов под действием ферментов микроорганизмов, приводящий к образованию различных продуктов. В зависимости от конечного продукта различают:
а) спиртовое брожение
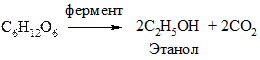
б) молочнокислое
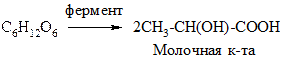
в) масляное
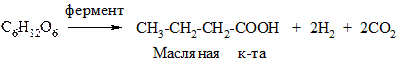
ЛЕКЦИЯ 11
Олигосахариды
Это углеводы, содержащие в молекуле 2-10 моносахаридных остатков. Наиболее важны дисахариды, то есть сахариды, содержащие два моносахаридных остатка. К ним относятся сахароза, мальтоза, лактоза и целлобиоза. При гидролизе их образуется два моносахарида. Сахароза – невосстанавливающий дисахарид, остальные – восстанавливающие. Все дисахариды являются гликозидами и содержат в своем составе a–D–глюкозу.
Молекула сахарозы состоит из a–D–глюкозы и b–D–фруктозы:
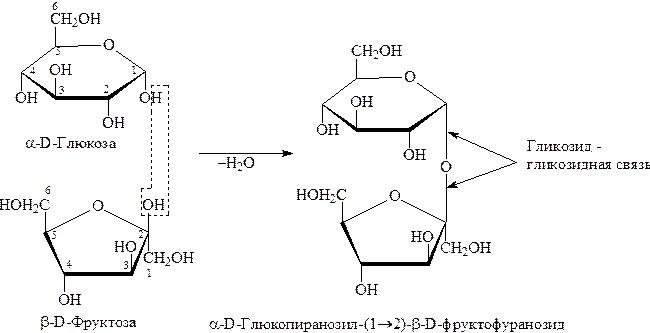
При образовании сахарозы оба моносахарида участвуют своими полуацетальными гидроксилами. Поэтому циклическая форма будет закреплена и оксо-форма (открытая) не образуется. Такой сахар обладает свойствами многоатомного спирта и гликозида. Восстанавливающие свойства отсутствуют : проба Троммера и реакция Толленса отрицательны. Подобно моносахаридам сахароза вступает в р-ции с Ме (активным), образует простые и сложные эфиры, дает качественную р-цию с Сu(ОН)2 – синее окрашивание:
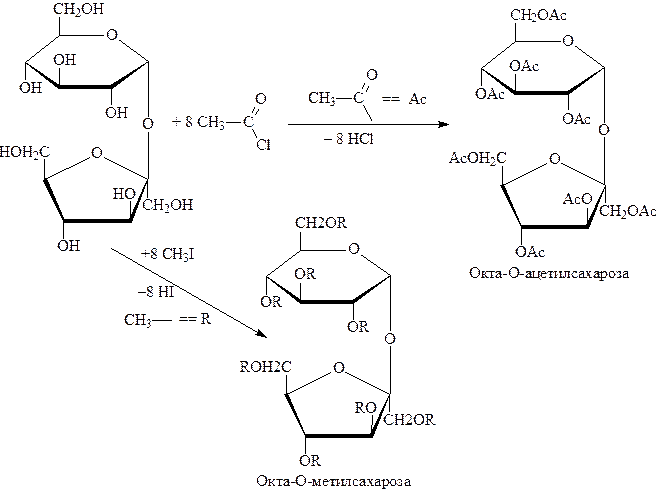
Сахароза, как гликозид, легко гидролизуется в кислой среде с образованием a–D–глюкозы и b–D–фруктозы. При этом происходит изменение угла вращения поляризованного света. Сахароза обладает правым вращением (+66,50), образующаяся фруктоза – левым (-920), глюкоза – правым (+52,50). Разница – -400.
Это явление называется инверсией сахара. Смесь глюкозы и фруктозы – инвертным сахаром. Природный инвертный сахар – мед.
Сладость сахарозы принята за 1, тогда фруктоза имеет сладость 1,73, глюкоза – 0,74, сорбит – 0,6, маннит – 0,4.
Специфические реакции
1. Сахароза после гидролиза дает положительную реакцию Селиванова, так как при гидролизе образуется фруктоза.
2. Проба Троммера и реакция Толленса отрицательны, так как в щелочной среде сахароза не гидролизуется.
Сахароза применяется в медицине для приготовления порошков, таблеток, сиропов, микстур и пр.
Важнейшими представителями восстанавливающих дисахаридов являются мальтоза, лактоза и целлобиоза.
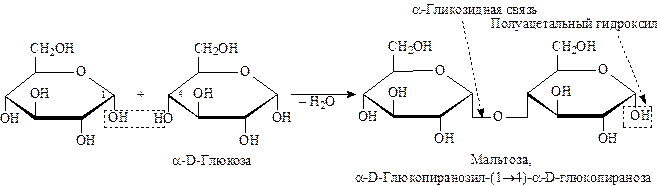
В растворе мальтоза существует в виде циклической и открытой формах (3 формы) за счет мутаротации:
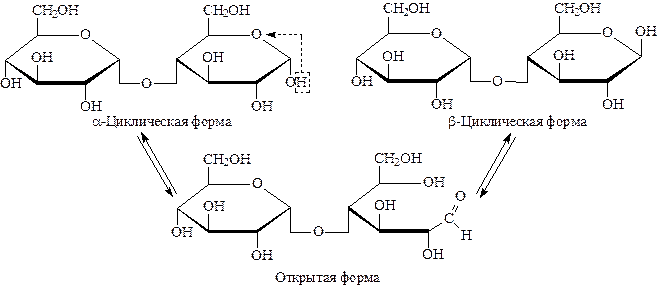
Дата добавления: 2017-12-05; просмотров: 1906;