Количественные зависимости электрохимического процесса
Явление электролиза с количественной стороны впервые было изучено Фарадеем, которому принадлежит честь открытия следующих двух важнейших законов электрохимии.
Закон 1. Количество вещества, которое окисляется на аноде или восстанавливается на катоде, пропорционально количеству протекшего электричества:
| m = aQ, | (4.10) |
где т - количество граммов вещества, которое окисляется или восстанавливается у электродов при прохождении Q кулонов электричества; а - коэффициент пропорциональности, зависящий от эквивалентного веса.
Закон 2. Количества окисляющихся или восстанавливающихся на электродах веществ при прохождении одного и того же количества электричества пропорциональны эквивалентным весам:
| m = bM, | (4.11) |
где М - эквивалентный вес данного вещества (Эквивалентный вес – это весовое количество простого или сложного вещества, соединяющееся с 8 весовыми частями кислорода или 1,008 весовых частей водорода либо замещающее те же количества кислорода или водорода в их соединениях. Так как вещества реагируют друг с другом в весовых количествах, пропорциональных их эквивалентному весу, то химические расчеты удобно производить, используя эквивалентный вес); b - коэффициент пропорциональности, зависящий от величины Q.
Общим выражением для обоих законов служит уравнение:
| m = cMQ | (4.12) |
где с зависит только от единиц измерения величин т и Q. Если т выражено в граммах, a Q в кулонах, то с представляет собой количество вещества, окисляющегося на аноде или восстанавливающегося на катоде при прохождении единицы количества электричества и носит название электрохимического эквивалента. При т = М из уравнения 4.12 следует, что
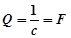 , ,
| (4.13) |
где F - количество электричества, при прохождении которого у каждого из электродов окисляется или восстанавливается один грамм-эквивалент вещества; это количество электричества, равное 96500 к (26,8 А-ч), называется постоянной Фарадея или Фарадеем. Из уравнений (4.12 и 4.13) следует:
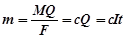 , ,
| (4.14) |
где I – сила тока; t – время. Это уравнение позволяет найти количество восстановленного или окисленного вещества т для данного вещества при прохождении через электролизер Q кулонов электричества или найти Q, если известно т.
На электродах при электролизе часто протекают два или несколько электрохимических процессов, один из которых в зависимости от назначения электролиза рассматривается как главный, а остальные – как побочные. Так, например, при электроосаждении металлов, стоящих в ряду напряжений выше водорода, часть электричества расходуется на выделение водорода. Для этих процессов главным является осаждение металла, а побочным – выделение водорода.
Законы Фарадея не указывают, какое из веществ в растворе подвергается при электролизе изменению, а только выражают зависимость между прошедшим количеством электричества и количеством грамм-эквивалентов всех веществ, претерпевающих химические изменения в результате электролиза. Следовательно, применяя законы Фарадея, требуется учитывать как главные, так и побочные процессы. Однако поскольку электролиз ведётся с целью получения какого-либо определенного продукта, появляется необходимость в том, чтобы определить долю израсходованного на этот процесс электричества. Для этого было введено понятие выхода по току η определяемое отношением количества вещества, фактически полученного при электролизе mф к теоретическому количеству его mТ, рассчитанному по закону Фарадея в предположении, что побочные процессы отсутствуют:
 . .
| (4.15) |
Так как из (4.14) mТ= Qc, получим
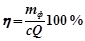 . .
| (4.16) |
В электрохимических расчетах часто пользуются величинами катодной и анодной плотности тока, определяя их как силу тока, приходящуюся на единицу площади данного электрода:
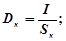 и и 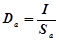
| (4.17) |
где Dк, и Da - катодная и анодная плотности тока; Sк, и Sа - площади катода и анода; I - сила тока, идущего через ванну, в A.
В ряде случаев, например, если продукты реакции при электролизе остаются растворенными в электролите, важно знать силу тока, приходящуюся на единицу объема электролита. Эта величина называется концентрацией тока, или объемной плотностью тока, и определяется соотношением:
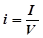 , ,
| (4.18) |
где I - сила тока в A; V - объем электролита; i - объёмная плотность тока в А/л.
Дата добавления: 2017-12-05; просмотров: 754;
