Четвертое положение теории цветности
Из приведенных данных вытекает четвертое положение теории цветности органических соединений.
Ионизация молекул органических соединений, приводящая к усилению электронодонорности ЭД-заместителей или к электроноакцепторности ЭА-заместителей, сопровождается сдвигом максимума поглощения в длинноволновую область спектра и увеличением интенсивности поглощения; ионизация молекул, приводящая к уничтожению электронодонорности ЭД-заместителей, оказывает противоположное действие.
Переход к 5 положению цветности
КОНКУРИРУЮЩИЕ И ПЕРЕКРЕЩИВАЮЩИЕСЯ СОПРЯЖЕННЫЕ СИСТЕМЫ
Сопряженные системы с одним ЭД- и одним ЭА-заместителем на концах являются простейшими. Присоединение к системе сопряженных двойных связей между концевыми ЭД- и ЭА-заместителями дополнительных ЭД-заместителей, новых ароматических колец, образование дополнительных связей между ароматическими ядрами, входящими в сопряженную систему, и другие изменения в молекуле оказывают очень сильное влияние на поглощение света.
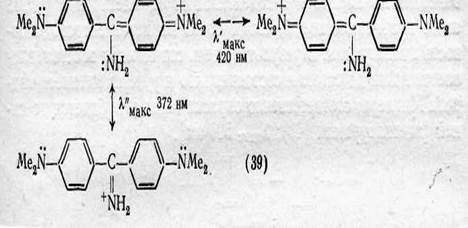
а) Введение второго ЭД-заместителя и разветвление сопряженной системы.Введение в молекулу с цепочкой сопряженных двойных связей и ЭД- и ЭА-заместителями на концах второго ЭД-заместителя приводит к тому, что на более близком расстоянии от ЭА-заместителя появляется новая пара подвижных неподеленных электронов. Эти электроны вступают во взаимодействие с ЭА-заместителем по более короткой сопряженной цепочке, чем та, по которой с ним взаимодействует пара электронов первого ЭД-заместителя. Возникающая конкуренция уменьшает постоянное (не зависящее от действия света) смещение электронов на участке между концевым и новым ЭД-заместителями. По своему действию это равносильно укорочению цепи сопряжения и, соответственно, приводит к сдвигу полосы поглощения в коротковолновую область спектра, т. е. к повышению окраски.
Так, присоединение аминогруппы к центральному атому углерода гидрола Михлера ( λ макс 603,5 нм) повышает цвет от синего до желтого [краситель Аурамин λмакс 420 нм]. Это объясняется тем, что новая аминогруппа создает возможность электронных переходов не только в первоначальной (пятизвенной) сопряженной системе, характерной для гидрола Михлера, но и в новой, более короткой (трехзвенной), т. е. возникает разветвленная сопряженная система.
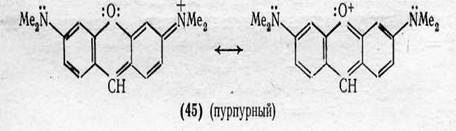
б) Замыкание гетероциклов.Разветвленные конкурирующие сопряженные системы возникают и при введении в молекулу с сопряженными двойными связями гетероатома с неподеленными электронами в составе мостика между ароматическими остатками, несущими ЭД- и ЭА-заместители, т. е. при замыкании гетероциклов. Например, в молекуле Пиронина (45), отличающегося от синего гидрола Михлера (λ макс 603,5 нм) наличием кислородного мостика между бензольными ядрами, наряду с электронным переходом в пятизвенной сопряженной системе, характерной для гидрола Михлера, возможны переходы и в двухзвенной сопряженной системе между атомом кислорода гетероцикла итем же ЭА-заместителем. В результате появляется вторая полоса поглощения с λ макс 510 нм. Что же касается первой полосы, то вследствие конкуренции она претерпевает гипсохромный СДВИГ ДО λ макс 550,5 НМ.
в) Перекрещивающиеся сопряженные системы.Если новый ЭД-заместитель или новая сопряженная цепочка присоединяются к молекуле в таком положении, что между ними и имеющимися заместителями или отдельными участками молекулы сопряжение невозможно, возникает перекрещивающаяся сопряженная система, которая характеризуется тем, что некоторые участки ее одновременно входят в несколько квазиавтономных сопряженных систем. В этих случаях возможные электронные переходы по затратам энергии мало отличаются друг от друга, и в спектре появляются близко расположенные полосы, сливающиеся в одну широкую полосу. В результате получаются неяркие («нечистые») оттенки («с примесью серого») — коричневатые, черноватые.
Так, в молекуле красителя Кислотного светло-коричневого для кожи (47) азогруппы и связанные с ними нафталиновое и бензольное ядра не сопряжены друг с другом (показаны две квазиавтономные сопряженные системы), тогда как центральное бензольное ядро и обе гидроксигруппы в нем находятся в сопряжении с каждой из азогрупп и связанным с нею ароматическим остатком. Вследствие этого в центральном бензольном ядре
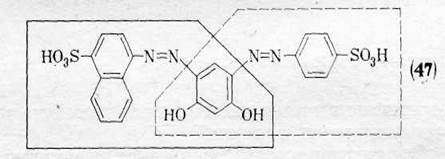
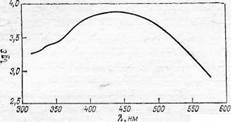
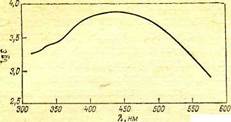 Рис.. Кривая поглощения красителя Кислотный светло-коричневый для кожи.
Рис.. Кривая поглощения красителя Кислотный светло-коричневый для кожи.
перекрещиваются две квазиавтономные сопряженные системы, причем π-электроны этого ядра и неподеленные электроны гидроксигрупп участвуют в смещении в обеих сопряженных системах. В результате возникает возможность ряда электронных переходов с образованием различных возбужденных предельных структур.
В спектре красителя появляются близко расположенные полосы, сливающиеся в одну широкую полосу (рис.), характерную для светло-коричневого красителя.
Дата добавления: 2017-11-04; просмотров: 768;
