Расчёт объёма воздуха, объёма и состава продуктов горения
При решении многих практических вопросов необходимо знать количество воздуха, расходуемого на горение единицы массы или объёма горючего вещества, количество образовавшихся продуктов горения и их процентный состав. Рассмотрим расчётные методы определения отдельных составляющих материального баланса процессов горения.
Методика расчёта объёма воздуха для горения зависит от состава горючего вещества, его агрегатного состояния и условий горения. По своей природе горючие вещества могут быть индивидуальными химическими соединениями и смесями сложных химических соединений. К индивидуальным химическим соединениям относятся такие вещества, которые имеют постоянное химическое строение и постоянную химическую формулу. К этой группе относятся такие вещества, как бензол (С6Н6), пропанол (С3Н9ОН), уксусная кислота (СН3СООН) и др. Смеси сложных химических соединений – вещества, не имеющие определённого химического строения, и их состав одной химической формулой выразить нельзя. К этой группе веществ относятся уголь, нефть, древесина, жиры и др. Состав этих веществ выражается в процентном содержании отдельных элементов или газов (C, S, H, и др. или СО, СН4, Н2S и др.).
Различают объём воздуха теоретически необходимый для горения (Vвтеор.) и объём воздуха действительно (практически) израсходованный на горение (Vвдейств.). При этом
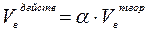 (2)
(2)
Множитель a называется коэффициентом избытка воздуха. Коэффициент избытка воздуха показывает, во сколько раз объём воздуха, поступивший на горение, больше теоретического объёма воздуха, необходимого для полного сгорания единицы количества вещества в стехиометрической смеси.
Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха (DVв).
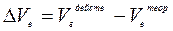 (3)
(3)
Объём продуктов горения, образовавшихся при сжигании единицы горючего (1 кг, 1 м3 , 1 кмоль) в теоретическом количестве воздуха, равен сумме объёмов углекислого газа, паров воды и азота:
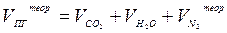 (4)
(4)
Полный, действительный объём продуктов горения находится с учётом избытка воздуха:
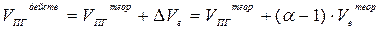 (5)
(5)
Для удобства расчётов горючие вещества разделяют на 4 группы (табл. 15): индивидуальные химические соединений (в газообразном и конденсированном состоянии); вещества сложного состава (древесина, торф, нефть и т.п.); смесь газов (генераторный, попутный газы и т.п.).
Таблица 15
Расчётные формулы для определения теоретического количества воздуха, необходимого для сгорания веществ.
| Группа горючих веществ | Расчётные формулы | Размерности |
| Индивидуальное горючее вещество в газообразном состоянии | 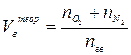 (6) (6)
| м3/м3 |
| Индивидуальное горючее вещество в конденсированном состоянии | 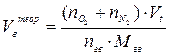 (7) (7)
| м3 /кг |
| Смесь газов | 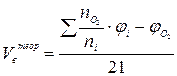 (8) (8)
| м3/м3 |
| Вещество сложного состава в конденсированном состоянии | 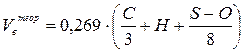 (9) (9)
| м3 /кг |
где 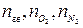 - количество горючего, кислорода и азота, получаемые из
- количество горючего, кислорода и азота, получаемые из
уравнения реакции горения, кмоль/кмоль;
Мгв – молекулярная масса горючего вещества;
Vt – молярный объём газа при заданных условиях, м3/кмоль;
C, H, S, O – весовое содержание соответствующих элементов в составе
горючего вещества, % масс.;
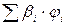 - сумма произведений стехиометрического коэффициента реакций
- сумма произведений стехиометрического коэффициента реакций
горения каждого компонента горючей смеси (bi) на процентное содержание
этого компонента (ji) в смеси;
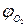 – процентное содержание кислорода в сложном горючем газе.
– процентное содержание кислорода в сложном горючем газе.
Для газообразных горючих веществ расчёт объёмов воздуха и продуктов горения проводят в м3/м3 . Так как 1 кмоль любого газа в одинаковых условиях занимает один и тот же объём (при нормальных условиях 22,4 м3), то объём, рассчитанный в м3/м3, численно будет таким же, как и в кмоль/кмоль.
Если горючее вещество находится в конденсированном состоянии (жидком или твёрдом), то, как правило, расчёты объёмов воздуха и продуктов горения проводят в м3/кг.
Для определения объёма воздуха при горении в условиях, отличных от нормальных, пользуются уравнением идеальных газов:
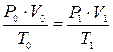 , (10)
, (10)
где Р0 – нормальное давление, Па;
Т0 – нормальная температура, К;
V0 – объём воздуха при нормальных условиях (м3 или м3/кмоль);
P1, T1, V1 – соответственно давление, объём и температура воздуха,
характеризующие заданные условия горения.
Иногда на практике приходится решать обратную задачу – по известному процентному содержанию кислорода в продуктах горения находить коэффициент избытка воздуха:
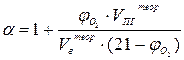 (11)
(11)
Для веществ, у которых объём продуктов горения равен объёму израсходованного воздуха (например горение углерода, серы), эта формула упрощается:
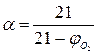 (12)
(12)
При расчёте объёма продуктов горения пользуются формулами, приведёнными в табл. 16.
Таблица 16
Расчётные формулы для определения теоретического объёма продуктов горения.
| Группа горючих веществ | Расчётные формулы | Размер-ности |
| Индивидуальное горючее вещество в газообразном состоянии | 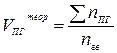 (13) (13)
| м3/м3 |
| Индивидуальное горючее вещество в конденсированном состоянии | 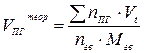 (14) (14)
| м3 /кг |
| Смесь газов | 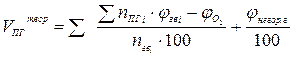 (15) (15)
| м3/м3 |
| Вещество сложного состава в конденсированном состоянии | 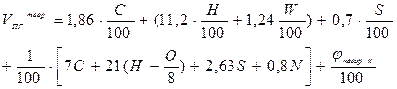 (16) (16)
| м3 /кг |
Процентный состав продуктов горения рассчитывается исходя их количества молей продуктов горения. Например, процентное содержание паров воды в продуктах горения составит:
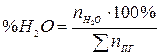 , % (17)
, % (17)
Если горение протекает с избытком воздуха, то при расчёте количества молей продуктов горения учитывается избыточное число молей кислорода и азота ( 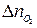 и
и 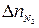 ):
):
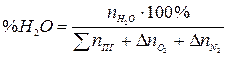 , % (18)
, % (18)
Рассмотрим примеры решения задач на расчёт объёма воздуха, объёма и состава продуктов горения.
Пример 1.Сгорает 4 м3 пропана (С3Н8). Рассчитать теоретические объёмы воздуха, объём и состав (в объёмных %) продуктов горения. Условия нормальные.
Решение.
Сгорает индивидуальное горючее вещество, находящееся в газообразном состоянии.
1. Запишем уравнение реакции горения пропана в воздухе:
С3Н8 + 5×(О2 + 3,76N2) = 3 CО2 + 4 Н2О + 3,76×5 N2
- Рассчитаем теоретические объёмы воздуха и продуктов горения по формулам (6) и (13) в расчёте на 1 м3 горючего вещества:
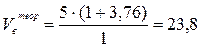 (м3/м3);
(м3/м3);
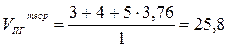 (м3/м3);
(м3/м3);
- Учитывая, что сгорает не 1 м3 газа, а 4 м3 находим действительные объёмы воздуха и продуктов горения:
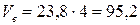 (м3);
(м3);
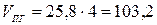 (м3).
(м3).
4. Рассчитаем состав продуктов горения:
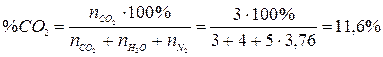
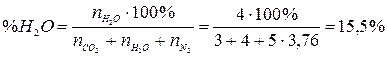
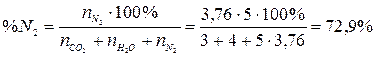 .
.
Ответ: на сгорание 4 м3 пропана необходимо 95,2 м3 воздуха, при этом образуется 103,2 м3 продуктов горения, из которых СО2 – 11,6 %, Н2О – 15,5 %, N2 – 72,9 %.
Пример 2. Сгорает 100 кг ацетона. Рассчитать действительные объёмы воздуха и продуктов горения, если коэффициент избытка воздуха равен 2. Условия нормальные.
Решение.
Сгорает индивидуальное химическое соединение в конденсированном состоянии. 1. Составляем уравнение реакции горения ацетона в воздухе:
С3Н6О + 4(О2 + 3,76 N2) = 3 CО2 + 3 Н2О + 4×3,76 N2
2. Объём воздуха, необходимый для сгорания 1 кг ацетона рассчитываем по формуле (7), учитывая при этом, что масса одного киломоля ацетона составляет 58 кг/кмоль:
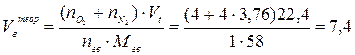 (м3/кг)
(м3/кг)
3. Действительный объём воздуха, пошедшего на сгорание 1 кг ацетона рассчитывается с учётом коэффициента избытка воздуха a:
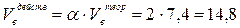 (м3/кг)
(м3/кг)
3. Избыток воздуха составит:
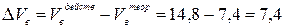 (м3/кг)
(м3/кг)
4. Теоретический объём продуктов горения рассчитываем по формуле (14):
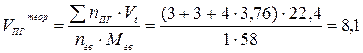 (м3/кг)
(м3/кг)
5. Действительный объём продуктов горения составит:
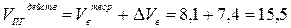 (м3/кг)
(м3/кг)
7. Объём воздуха теоретически необходимого для сгорания 100 кг ацетона составит соответственно 740 м3 (7,4 × 100), при этом выделится 1 550 м3 продуктов сгорания.
Ответ: При сгорании 100 кг ацетона объём воздуха при нормальных условиях составит 1 480 м3, а объём продуктов горения – 1 550 м3.
Примечание. Если в процессе горения была задана другая температура, то объём продуктов горения и воздуха рассчитывается с учётом объёма, который занимает один кмоль газа при этой температуре:
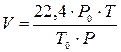 (19)
(19)
где Р0 =101,3 кПа; Т0 = 273 К; Т и Р заданные температура и давление.
Пример 3.Газовая смесь объёмом 10 м3 , состоящая из 30 % ацетилена, 40 % пропана, 20 % углекислого газа и 10 % сгорает с 40 %-ным избытком воздуха. Вычислить объём воздуха, принимающего участие в горении, если процесс протекает при нормальных условиях.
Решение.
1. Составляем уравнения реакций горения горючих газов смеси в воздухе:
С2Н2 + 2,5 (О2 + 3,76 N2) = 2 СО2 + Н2О + 2,5 3,76 N2
С3Н8 + 5 (О2 + 3,76 N2) = 3 СО2 + 4 Н2О + 5×3,76 N2
2. Рассчитаем теоретические объёмы воздуха и продуктов горения при полном сгорании 1 м3 газовой смеси (формулы 8 и 15):
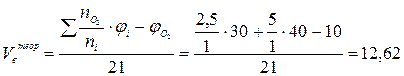 (м3/м3)
(м3/м3)
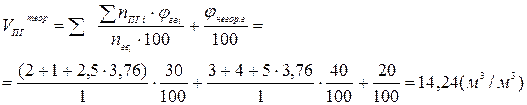
3. Рассчитаем действительные объёмы воздуха и продуктов горения с учётом 40 % - ного избытка воздуха (a = 1,4).
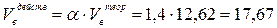 (м3/м3)
(м3/м3)
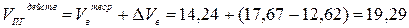 (м3/м3)
(м3/м3)
4. Поскольку объём горючей смеси составлял 10 м3, действительные объёмы воздуха и продуктов горения составят 176,7 и 192,9 м3 соответственно.
Пример 4.Определить объёмы воздуха и продуктов горения при сжигании 2 кг горючего вещества, имеющего элементный состав: С = 50 %; Н = 10 %; N = 10 %; золы = 12 %; влаги = 18 %. Считать, что воздух и продукты горения находятся при нормальных условиях.
Решение.
1. Для решения задачи воспользуемся формулами (9) и (16).
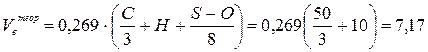 (м3/кг)
(м3/кг)
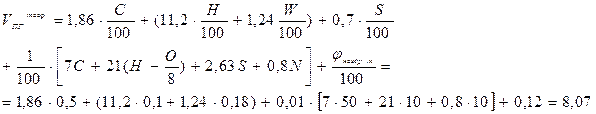 (м3/кг)
(м3/кг)
2. При сгорании 2 кг горючего вещества образуется соответственно 14,34 и 16,14 м3 воздуха и продуктов горения.
Ответ: При сгорании 2 кг горючего вещества образуется соответственно 14,34 и 16,14 м3 воздуха и продуктов горения.
Дата добавления: 2017-02-20; просмотров: 4022;
