Закономерности управления простым необратимым гомогенным процессом
Характеристика модели:
1) Процесс простой – можно описать одним стехиометрическим уравнением
аА + bВ → cС + dD, где С – целевой продукт;
β = α, так как весь реагент превращается только в целевой продукт.
2) Процесс необратимый – αmax = 100%.
Величина конверсии реагента изменяется во времени α = f (τ), стремясь к максимальной величине 100%, так как текущая концентрация реагента «С» уменьшается во времени, стремясь к нулю. 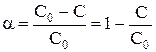
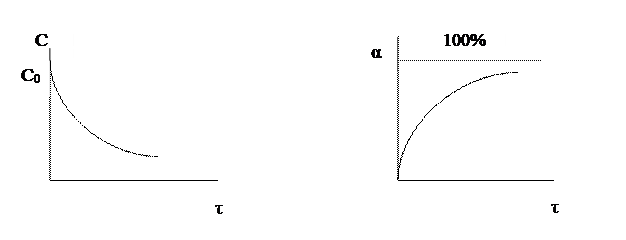
Чем меньше время достижения 100%-ной конверсии, тем эффективнее протекает реакция. То есть эффективность зависит от скорости химической реакции r .
1) Процесс гомогенный – скорость процесса равна скорости химической реакции.
На основе приведенной характеристики модели видно, что эффективность проведения простого необратимого гомогенного процесса определяется величиной скорости химической реакции, то есть единственным объектом управления является скорость химической реакции.
Инструментами управления простым необратимым гомогенным процессом являются те технологические параметры, которые влияют на скорость химической реакции, то есть температура, давление, концентрация реагента, природа и концентрация катализатора.
r = f (t, p, C, kat)
1) Влияние концентрации
Зависимость скорости химической реакции от концентрации реагентов выражается законом действующих масс:
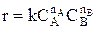 ,
,
где k – константа скорости, СА и СВ – текущие концентрации реагентов, nA и nB - порядок реакции по реагенту А и В соответственно.
Анализ уравнения закона действующих масс приводит к выводу, что:
1) скорость химической реакции увеличивается при увеличении концентрации реагентов;
2) скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше;
3) скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ.

Из уравнения закона действующих масс вытекает возможность использования двух технологических приемов, позволяющих увеличить скорость химической реакции:
1) работа с более концентрированным сырьем; при необходимости сырье предварительно обогащают, то есть тем или иным способом увеличивают в нем содержание основного компонента;
2) использование избытка одного из реагентов; что позволяет сохранять в ходе реакции высокие значения произведения 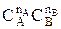 , а, следовательно, и высокую скорость процесса.
, а, следовательно, и высокую скорость процесса.
В избытке берется тот реагент:
- порядок по которому выше;
- стоимость которого ниже;
- отделение которого от продуктов проще.
Избыток не должен сильно разбавлять реакционную смесь, нарушать теплофизические свойства реакционной смеси и тепловое регулирование реактора. Кроме того, слишком большой избыток реагента приводит к лишним экономическим затратам. Величину избытка определяют экспериментально; обычно берут избыток реагента 1,7 – 1,8 по сравнению со стехиометрией.
Вполне очевидно, что, чем выше скорость химической реакции, тем меньше время достижения одной и той же величины конверсии.
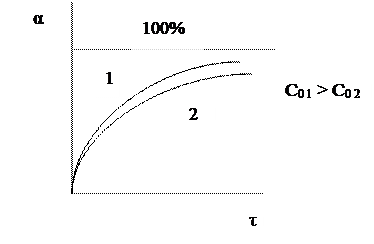
Поэтому при больших начальных, а, следовательно, и текущих концентрациях реагента время проведения химической реакции уменьшается.
Анализ кривой α = f (τ) также показывает, что скорость изменения конверсии уменьшается во времени, и при значениях α, близких к 100%, изменение конверсии очень незначительно. Поэтому всегда существует некоторое оптимальное значение конверсии (обычно 80-90%), при достижении которого вести процесс дальше экономически нецелесообразно. Время достижения этой величины конверсии называют оптимальным временем реакции τопт..
3) Влияние давления
Скорость реакции зависит от числа столкновений реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше).
В случае газофазных реакций концентрации реагентов в кинетическом уравнении можно заменить их парциальными давлениями.
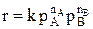
Известно, что парциальные давления компонентов смеси пропорциональны их мольным долям.
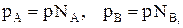
где р – общее давление, NA и NB – мольные доли компонентов А и В.
Тогда 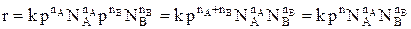 , где n = nA + nB.
, где n = nA + nB.
То есть скорость газофазной реакции пропорциональна давлению в степени, равной порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка.
Зависимость конверсии от давления при τ = const имеет следующий вид:
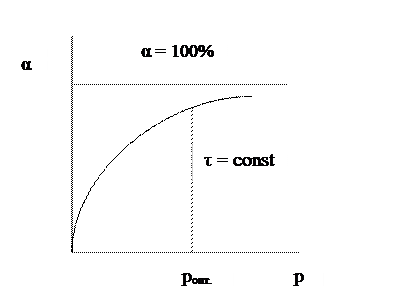
При увеличении давления конверсия увеличивается. Однако повышение давления имеет предел; выше некоторого оптимального значения давления ропт. увеличение его приводит к незначительному увеличению конверсии и выхода целевого продукта и поэтому становится нецелесообразным.
На практике использование давления в качестве фактора управления химической реакцией ограничено большими затратами на его реализацию и возможностями техники высокого давления.
4) Влияние температуры
Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры.
Скорость химической реакции возрастает при увеличении температуры на 100 в 2 - 4 раза. Это эмпирическое правило называется правилом Вант-Гоффа. Оно справедливо в области средних температур (до 4000С).
Более точно влияние температуры можно описать уравнением Аррениуса: 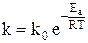 ,
,
где Еа – энергия активации, Т – температура, R – газовая постоянная, k0 – предэкспоненциальный множитель, зависящий только от природы реагирующих частиц.
Подставим это уравнение в уравнение закона действующих масс

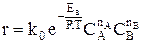
и увидим, что скорость химической реакции при увеличении температуры возрастает по экспоненте. Степень влияния температуры зависит от величины энергии активации. Реакции с большей энергией активации более чувствительны к изменению температуры, реакции с малой энергией активации нечувствительны.
Каждая реакция значительно более чувствительна к изменению температуры при низких температурах, чем при высоких.
Установим зависимость конверсии от температуры. Эта зависимость носит S-образный характер.
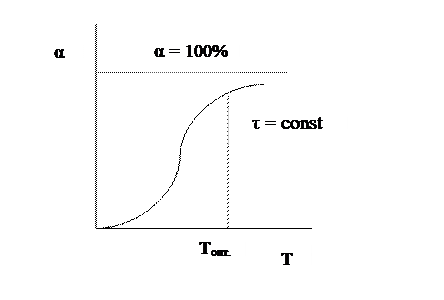
При низких температурах мала скорость процесса, поэтому невелик подъем кривой α = f (T). По мере повышения температуры скорость реакции увеличивается по экспоненте, что приводит к резкому подъему кривой. Но с увеличением степени превращения реагентов снижается их концентрация, а, следовательно, и скорость процесса, поэтому функциональная зависимость α = f (T) асимптотически приближается к единице.
Анализ кривой на графике приводит к выводу, что в данном случае тоже существует некоторое оптимальное значение задаваемого параметра – температуры, выше которого вести процесс экономически нецелесообразно из-за незначительного увеличения конверсии при высоких энергетических затратах.
Термический способ активации химической реакции очень часто используется в технологии (до 95% от общего числа промышленных синтезов). Недостатком этого способа является высокие энергетические затраты и низкая селективность (при повышении температуры ускоряются не только целевые реакции, но и побочные).
Обобщая вышесказанное, можно сделать вывод, что в случае простого необратимого гомогенного процесса конверсия реагентов и выход целевого продукта изменяются синхронно и стремятся к 100% с увеличением времени нахождения реагентов в зоне реакции. Время достижения нужного значения конверсии можно сократить, увеличивая скорость химической реакции. Таким образом, эффективность такого процесса определяется только величиной скорости химической реакции.
Для увеличения скорости реакции используют следующие технологические приемы:
1) работа с высококонцентрированным сырьем;
2) использование избытка одного из реагентов;
3) использование оптимального давления в случае газофазных реакций;
4) активация реакции тем или иным способом, например, повышением температуры.
Однако следует помнить, что в технологической практике иногда избегают излишнего повышения скорости реакции. Обычно это связано с трудностями быстрого теплоотвода в случае сильноэкзотермических реакций. В таких процессах используют малоконцентрированное сырье или даже разбавляют реакционную массу, например, введением растворителя или инертного газа.
Лекция № 3
Дата добавления: 2017-10-09; просмотров: 687;
