АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО - ГАЗ
Как уже отмечалось ранее, адсорбцией называется сгущение газообразного или растворенного вещества на поверхности раздела фаз. Газ или растворенное вещество принято называть в этом случае адсорбтивом, а жид-кость или твердое тело, адсорбировавшее их, — адсорбентом. Для твердых адсорбентов характерно явление абсорбции - поглощение вещества в объеме. Адсорбция и абсорбция объединяются общим термином - сорбция.
Так как адсорбция является поверхностным явлением, она имеет огромное значение для коллоидных систем, обладающих большой поверхностью. Коагуляция лиозолей, пептизация коллоидных осадков, изменение знака заряда частиц и тому подобные явления теснейшим образом связаны с адсорбцией.
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Известно, что если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция ↔ Десорбция.
Десорбция обусловлена тепловым движением. При адсорбции на поверхности возникает адсорбционный комплекс, который при десорбции разрушается, и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных — неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8 — 40 кДж/моль, т.е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается, так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями.
2. Специфичность. Адсорбция происходит, если возможна химическая реакция.
3. Высокая теплота адсорбции, которая может достигать 800-1000кДж/моль, т.е. сопоставима с тепловыми эффектами химических реакций.
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
Количественно адсорбция может быть выражена:
1) величиной а, представляющей собою количество адсорбтива, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента. Эту величину обычно измеряют в моль/г;
2) величиной α, показывающей количество адсорбированного вещества, приходящегося на единицу поверхности адсорбента. Эта величина представляет собой поверхностную концентрацию адсорбтива. Единицами измерения ее являются моль/м2и ммоль/см2.
3) введенной Гиббсом величиной Г, представляющей собою избыток числа моль адсорбтива в объеме поверхностного слоя площадью 1 см2 по сравнению с числом его моль в том же объеме, если бы у межфазной границы не происходило изменения концентрации адсорбтива. При малых концентрациях адсорбтива гиббсовская адсорбция Г близка к поверхностной концентрации α, при больших концентрациях адсорбтива величина Г отличается от α. В случаях, когда по тем или иным причинам концентрация в поверхностном слое меньше его концентрации в объеме, величина Г отрицательна, а само явление называется отрицательной адсорбцией.
Адсорбцию можно характеризовать:
1) зависиостью количества адсорбированного вещества а от температуры при постоянных равновесных давлении р или концентрации с; графики а = f(T] при р = const называются изобарами, а при с = const — изопикнами адсорбции (рис.20 б);
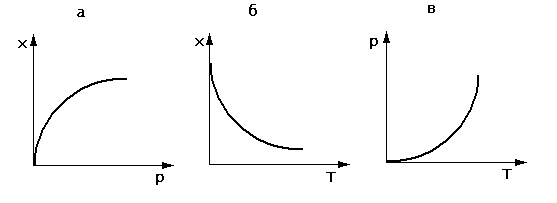 |
| Рис. 20. Изотерма (а), изобара (б), изостера (в) адсорбции |
2) зависимостью равновесного давления (или концентрации) от температуры при постоянном количестве адсорбированного вещества; графики р = f(T) и с = f(T) при а = const называются изостерами (рис. 20 в)
3) зависимостью количества адсорбированного вещества а от равновесного давления (или концентрации) при постоянной температуре; графики а = f (р) или а = f(c) при Т = const называются изотермами адсорбции (рис. 20а). Изотермы имеют особенно большое значение при изучении адсорбции, поэтому в дальнейшем мы ограничимся в основном рассмотрением этой зависимости.
Дата добавления: 2017-10-09; просмотров: 3070;
