ВТОРОЙ 3AKОH ТЕРМОДИНАМИКИ. ЭНТРОПИЯ. ЭНЕРГИИ ГИББСА И ГЕЛЬМГОЛЬЦА. КРИТЕРИЙ САМОПРОИ3ВОЛЬНОГО ПРОТЕКАНИЯ ПРОЦЕССА
Пример 1. Один моль кислорода расширяется до десятикратного увеличения объема и одновременно охлаждается от 400К до 300К. Чему равно изменение энтропии, если для заданного
температурного интервала мольная изобарная теплоемкость кислорода C = 29,2 Дж/моль*К (Ср считаем в данном интервале температур постоянной).
Решение. Общее изменение энтропии ΔS будет складываться из изменения энтропии газа ΔS1 при его расширении и изменения энтропии газа ΔS2 при изменении температуры:
ΔS1= R ln 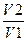 , (1.3.1)
, (1.3.1)
где R - газовая постоянная; V1 и V2 — соответственно конечный и начальный объемы газа. .Находим по формуле (1.3.1)
ΔS1= 8,31*ln10=19,1 Дж/моль*K.
ΔS2 =Cp*ln 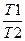 , (1.3.2)
, (1.3.2)
где С - мольная изобарная теплоемкость О2; Т2 и Т1 — конечная и начальная температуры.
Отсюда
ΔS2 = 29,2·1n 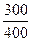 = -8,05 Дж/моль*К, тогда ΔS = ΔS1+ΔS2= 19,1-8,05 = 11,05 Дж/моль*К.
= -8,05 Дж/моль*К, тогда ΔS = ΔS1+ΔS2= 19,1-8,05 = 11,05 Дж/моль*К.
Ответ. ΔS = 11,05 Дж/моль*К.
Пример 2. При охлаждении 12 л кислорода от 473 до 233 K одновременно повышается давление от 105 до 6·106. Рассчитать изменение энтропии, если мольная изобарная теплоемкость кислорода Ср = 29,2 Дж/моль*К (газ считать идеальным).
Решение. Рассчитаем число молей кислорода из уравнения состояния идеального газа
pV= nRT ; n= 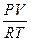 =(105*12*10-3)/(8,31*473)= 0,3052 моля.
=(105*12*10-3)/(8,31*473)= 0,3052 моля.
Общее изменение энтропии ΔS будет складываться из изменения энтропии ΔS1 при увеличении давления и изменения энтропии ΔS2 при охлаждении газа
ΔS1 =R ln 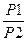 , (1.З.З)
, (1.З.З)
где Ρ1 и Ρ2 — исходное и конечное давления; R — газовая постоянная.
ΔS2 находим по формуле (1.3.2).
Отсюда
ΔS = R ln 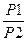 + Cpln
+ Cpln 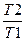 .
.
Так как у нас участвует 0,3052 молей кислорода, то
ΔS =0,3052(8,31*ln(105/(6*106)) + 29,2*ln(233/437))=-16,77 Дж/моль*К.
(энтропия уменьшается при охлаждении газа).
Ответ. ΔS = —16,77 Дж/моль*К.
Пример 3. Определить изменение энтропии ΔS при нагревании 30 г ледяной уксусной кислоты (СН3 СООН) от температуры плавления до 333 K. Τпл уксусной кислоты 289,6 K. Теплота
плавления ΔΗпл= 194 Дж/г, удельная теплоемкость уксусной кислоты равна 2,19 Дж/г*К.
Решение. Общее изменение энтропии Δ S Равно сумме изменения энтропии при плавлении уксусной кислоты Δ S1 и при нагревании жидкой уксусной кислоты от Τпл до заданной температуры (333 К) Δ S2
Δ S1= Δ Hпл/Tпл (1.3.4)
1 моль СН3СООН= 60 г.
По формуле (1.3.4) находим Δ S1=194*30/289,6*60=20,1 Дж/К
Δ S2 рассчитываем по формуле (1.3.2):
Δ S2=Сpln(T2/T1)=2,19*30ln(333/289,6)=9,20 Дж/К.
Тогда
Δ S = Δ S1 + Δ S2= 20,1+9,2=29,3 Дж/К.
Ответ: Δ S = 29,3 Дж/К.
Пример 4. Определить изменение энтропии ΔSо и энергии Гиббса ΔGо при стандартных условиях для системы
Fe3О4 + CO = 3FeO + CO2
и решить вопрос о возможности самопроизвольного протекания ее при указанных условиях.
Решение. Значения ΔSо и ΔGо Для реакции определяем по следствию из закона Гесса (2.2.1). Стандартные энтропии S°298 и энергии Гиббса ΔGо 298 компонентов берем из табл.3.
Следовательно,
продукты реагенты
ΔSо = ∑ νj S°298 - ∑νi S°298.
или
ΔSо = 3Sо298 FeO + Sо298 CO2 - Sо298 Fe3O4 - Sо298 CO =3*58,79 + 213,6 -151,46 – 197,4 = 39,11Дж
продукты реагенты
ΔGо = ∑ νj ΔGо 298 - ∑νi ΔGо 298. (1.3.6)
или
ΔGо = 3 ΔGо 298 FeO + ΔGо 298 CO2 - ΔGо 298 Fe3O4 - ΔGо 298 CO = 3(-246,0) – 394,89 +1010 +137,4 = 14,51 кДж
Если ΔG < О, процесс идет самопроизвольно, при ΔG > 0 процесс не идет. В данном случае ΔG > 0, следовательно, процесс самопроизвольно не пойдет.
Ответ. ΔS° = 39,11 Дж; ΔGо = 14,51 кДж, реакция самопроизвольно не пойдет.
Пример 5. Вычислить стандартное значение изменения свободной энергии ΔGо реакции: C2H2+5/2 О2 = 2 CО2 + Н2О (ж); ΔGо,
По табличным данным -Sо298 и ΔΗо298 для компонентов (табл. 3).
Решение. Определяем тепловой эффект и изменение энтропии реакции по закону Гесса (формулы (1.2.1) и (1.3.5)).
ΔΗ° = ΔΗ°298 H2O + 2ΔΗ°298 CO2 - 2ΔΗ°298 C2H2= -285,8+2* (-394)-226,8= -1299,6 кДж/моль;
ΔS°= Sо298 H2O + 2Sо298 CO2 - Sо298 C2H2 – 5/2Sо298 O2 =
= 70+2213,6-200,8-2,5*205= -216,2 Дж/моль*К;
ΔS°= -0,2162 кДж/моль*К.
Изменение изобарно-изотермического потенциала находим по формуле
ΔG° = ΔΗ°- T ΔSо, (1.3.7)
ΔG°= -1299,6+0,2162*298= -1235,19 кДж/моль.
Таким образом, ΔGо < 0 - самопроизвольный процесс возможен.
Ответ. ΔGо =-1235,19 кДж.
Задачи
39. Определить изменение энтропии для 1 кг воздуха при нагревании его от 223 до 323 К (при этом происходит изменение давления от 106 до 105 Па). Массовая теплоемкость воздуха 1,005 Дж/г*К. Средняя молекулярная масса воздуха 29.
40. Средняя массовая теплоемкость железа равна 0,486 Дж/г* К. Определить изменение энтропии ΔS при нагревании 1 кг железа от 100 до 150оС.
41. Определить суммарное изменение энтропии при нагревании 1 моля бензола от температуры плавления (5,49 С) до полного испарения при температуре кипения (80,2оС). Теплота
плавления бензола 126,54 Дж/г, теплота парообразования 396 Дж/г, массовая теплоемкость бензола 1,94 Дж/г* К.
42. Вычислить cyммаpное изменение энтропии при нагревании 1 моля воды от темпеpатуpы плавления до полного иcпаpения пpи температypе кипения. Теплота плавления льда 335,2 Дж/г, теплота паpообpазоваиия воды 2260 Дж/г, маccовая теплоемкость воды 4,188 Дж/г*K.
43. Вычиcлить изменение энтpопии ΔS пpи cтандapтныx
уcловияx для yравнений pеакций:
2H2S+SO2=2H2O(ж)+3S(кр) ; Zn(кр)+H2SO4(ж) = ZnSO4(ж) + H2(г).
CH4 + 2O2 = CO2 +2H2O(r) .
44. Oпpеделить изменение энеpгии Гиббcа для реакции
N2+2H2O(ж)=NH4NO2; ΔGo
и дать заключение о возможноcти ее пpотекания пpи cтандаpтных ycловиях.
45. Вычиcлить изобарно-изотeрмичecкий потеициал ΔGo реакций и дать заключение о возможноcти иx пpοтекания пpи cтандаpтныx yсловияx:
а) 3С2H2=C6H6 ; ΔGo1 ;
б) CO2+2NH3→NH2-CO-NH2 + H2O(ж) ; ΔG°2;
в) СH3-CH2-CH2OH→ CH3-СН=СН2 + Н2О(ж); ΔG°3.
46. Hе пpоизводя вычиcлений, ycтанοвить знак ΔS cледyющиx пpоцеcсов:
а) 2NH3(г)=N2(г)+3H2(г) ;
б) CO2(кр)=CO2(г) ;
в) 2NO(г)+O2(г)=2NO2(г) ;
г) 2H2S(г)+3O2(г)=2H2O(ж)+2SO2(г) ;
д) 2CH3OH(г)+3O2(г)=4H2O(г)+2CO2(г).
47. Опpеделить знак изменения энтpoпии для pеакций:
2A2(г)+B2(г)=2A2B(ж).
Возможно ли пpотекание этой pеакции в cтандаpтныχ ycловияx? Ответ обоcновать.
48. Установить, пpотекание какиx из нижеcледyющих pеакций возможно в cтандаpтных ycловияx пpи 298 K:
а) N2(г)+1/2O2(г) =N2O(г);
б) 4HCl(г)+ O2 (г) = 2Cl2 (г) + 2H2O(ж) ;
в) Fe2O3(кр)+ 3CO(г)=2Fe(кр)+ 3CO2(г) .
49. Вычислить ΔG для реакции:
CаCO3(кр) = СаО(кр)+CO2(г)
при 298 К, 773 К и 1773 K. Зависимостью ΔH , ΔS от температуры пренебречь. Построить график зависимости ΔG от температуры и найти по графику температуру, выше которой указанная реакция может протекать самопроизвольно.
50. Вычислить ΔG°298 следующих реакций восстановления
оксида железа (II):
а) FeO(кр) + 1/2 C(гр) = Fe(кр) + 1/2 CО2 (г);
б)FeO(кр) + C(гр) = Fe(кр) + CO(г) ;
в) FeO(кр) + CO(г) = Fe(кр) + CO2(г) .
Протекание какой из этих реакций наиболее вероятно?
51. Указать, какие из реакций образования оксидов азота,
и при каких температурах (высоких или низких) могут протекать самопроизвольно:
а) 2N 2(г) + O2 (г) = 2N2O(г) ; Δ Hо298>0 ;
б) N2(г) + O2(г) = 2NO(г) ; Δ Hо298>0 ;
в) 2NO(г) + O2(г) = 2NO2(кр); Δ Hо298<0 ;
г) NO(г) + NO2(г) = N2 O3 (кр) ; Δ Hо298<0 ;
д) N2(г) + 2O2(г) = 2NО2(г) ; Δ Hо298>0 ;
52. На основании расчета ΔG°298 реакций сделайте вывод,
какие из перечисленных ниже окислов могут быть восстановлены алюминием при 298 К: CаО; FеO; СuО, PbO; Fe2O3 ; Cr2O3?
53. Можно ли получить пероксид водорода H2О2 по реакции:
2H2O(ж) + O2 (г) = 2N2O2(ж).
54. Возможно ли горение кальция в атмоофере оксида углерода по реакции
Са (кр) + CО(г) = CаO(кр) + C(кр).
55. Чему равно изменение энтропии Δ S при плавлении одного моля льда при 273,15 K, если изменение энтальпии при плавлении льда Δ Hпл= 6016,8 Дж/моль.
Дата добавления: 2017-08-01; просмотров: 3824;
