Нитрофенилалкиламины
Хлорамфеникол (левомицетин) – антибиотик ароматического ряда, его эфиры - стеарат и сукцинат.
Природный ароматический антибиотик хлорамфеникол продуцируется почвенным актиномицетом Actinomyces venezuelae. Штамм этого продуцента был впервые выделен из почв Венесуэлы (1947), откуда он и получил свое название.
Хлорамфеникол – антибиотик широкого спектра действия. Он действует не только на грамположительные и грамотрицательные бактерии, но и на риккетсии, вызывающие брюшной и сыпной тифы, бруцеллез, холеру и др.
Такой широкий диапазон действия антибиотика привлек к нему большое внимание исследователей, и в течение двух лет было не только изучено его химическое строение, но и осуществлен синтез (США, 1949). Почти одновременно в нашей стране академик М.М.Шемякин с группой сотрудников провел большую работу по синтезу аналогов хлорамфеникола и изучению связи между его строением и антибиотическим действием. При этом оказалось, что биологическая активность хлораминофеникола находится в большой зависимости от пространственной конфигурации молекулы.
Хлорамфеникол относится к производным n-замещенных нитробензолов.
При гидролизе хлорамфеникола получается соединение, содержащее аминогруппу – основание хлорамфеникола (1) и дихлоруксуная кислота (2).
1 2
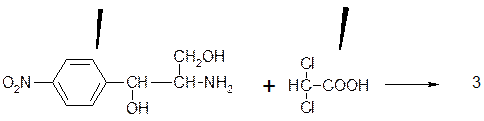
При конденсации полученных продуктов получается хлорамфеникол (3), молекулу которого можно представить следующим образом:
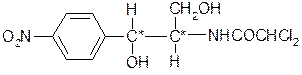
Д(-)-трео-1-(4-нитрофенил)-2-дихлорацетил-аминопропандиол-1,3.
Хлорамфеникол имеет 2 ассиметричных атома углерода, поэтому возможно существование 4 стереоизомеров или 2-х пар антиподов:
1. Трео-изомер (транс-положение групп): Д(+); Д(-); L(+); L(-), Д(-)-левомицетин, остальные токсичны.
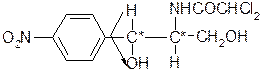
2. Эритро-изомеры (цис-расположение): Д(+); Д(-); L(+); L(-). Оба изомера Д(+); Д(-) и L(+); L(-) – очень токсичны.
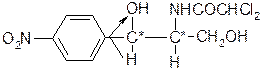
Синтез:
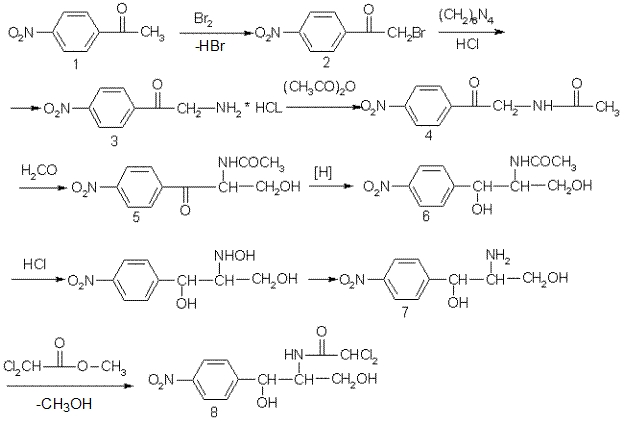
1) n-нитроацетофенон.
2) n-нитро-α-бромацетофенон.
3) n-нитро-α-аминоацетофенона гидрохлорид.
4) n-нитро-α-ацетиламиноацетофенон.
5) n-нитро-α-ацетиламино-β-оксипропиофенон.
6) Д,L-трео-1-n-нитрофенил-2-ацетилацетилпропандиол-1,3.
7) Д,L-трео-1-n-нитрофенил-2-ацетиламинопропандиол-1,3.
8) левомицетин
В реакции 7-8 участвует Д-(-)-трео-изомер, который получается при разделении на оптические антиподы Д,L-трео1-n-нитрофенил-2-ацетиламинопропандиола-1,3.
Смесь Д-(-) трео-изомера (левовращающего) левомицетина и L-(+) - трео-изомера (правовращающего антипода) левомицетина называется синтомицином и используется для наружного применения в виде мазей, линиментов как антибактериальное средство (50% биологической активности).
Медицинские препараты:
1. Левомицетин – Laevomycetinum
Тпл.=149-153°; [α]Д=+18 до +21° 15% раствор в спирте.
Беловато-желтоватый, иногда с зеленым оттенком порошок. Вкус горький, мало растворим в воде, эфире, хлороформе, легко растворим в спирте.
2. Левомицетина стеарат – Laevomycetini stearas
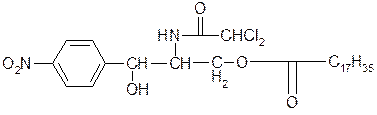
Д-(-)-трео-1-нитрофенил-2-дихлорацетиламинопропандиола-1,3-3-стеарат
Тпл.=88-90°С;[α]Д= +15 до +20° в 5% раствор в спирте.
Трудно растворим в эфире, спирте, воде, легко в хлороформе.
3.Левомицетина сукцинат растворимый – Laevomycetini succinas solubile
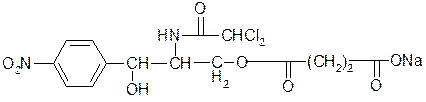
Д-(-)-трео-1-нитрофенил-2-дихлорацетил-аминопропандиол-1,3-3-сукцинат натрия.
[α]Д= -11 до -12,6°(10% раствор в смеси метанола, воды и HCl)
Не растворим в хлороформе, легко растворим в воде.
Препараты различаются по растворимости, удельному вращению, по температуре плавления, по УФ-спектрам:
Левомицетин – λмах.= 278нм.
Левомицетина стеарат - λмах.= 272нм.
Левомицетина сукцинат - λмах.= 275нм.
Физические свойства можно использовать при идентификации.
Дата добавления: 2017-08-01; просмотров: 1381;
